子宮内膜症の発症における腸内細菌叢の役割:総説
本文へスキップ
トップバーナビゲーション
微生物学のフロンティア
セクション
論文
研究トピックス
編集委員会
ジャーナルについて
私たちについて
すべてのジャーナル
すべての記事
研究を投稿する
記事のダウンロード
共有する
レビュー記事
Front. 微生物学, 05 3月 2024
システム微生物学
第15巻 - 2024年|https://doi.org/10.3389/fmicb.2024.1363455
この論文は次の研究テーマの一部です。
データ駆動型アプローチによるヒト微生物叢と複雑な疾患との広範なつながりと緊密な相互作用の解明、第2巻
全25記事を見る
子宮内膜症の発症における腸内細菌叢の役割:総説
https://www.frontiersin.org/journals/microbiology/articles/10.3389/fmicb.2024.1363455/full?utm_source=S-TWT&utm_medium=SNET&utm_campaign=ECO_FCIMB_XXXXXXXX_auto-dlvrit
郭翠山Cuishan Guo
チャン・チユアン
チャン・チユアン
*
中国、瀋陽、中国医科大学盛京病院産科婦人科
子宮内膜症は、古典的には、体のあらゆる部位に発生する慢性炎症性不均質疾患と定義され、エストロゲン駆動性の周期的出血、増殖、子宮外の異所性子宮内膜腺と間質の線維化を特徴とする。子宮内膜症は、複数の臓器の構造と機能に圧倒的に深刻なダメージを与え、全身のシステムを損なうことさえあり、その結果、生殖年齢の女性の5〜10%に、重度の月経困難症、慢性骨盤痛、不妊症、疲労、うつ病を引き起こす。子宮内膜症は、その根本的な病因と複雑な病態に関する認識が非常に不足しているため、早期診断と比較的副作用の少ない治療法がネックとなっている。従って、子宮内膜症は、病因についてより深く探求し、研究を拡大することが必要である。腸内細菌叢は、身体の代謝と免疫に重要な役割を果たし、調節因子として働くことによって、ヒトの慢性疾患に重要な役割を果たしている。腸内細菌叢が炎症、エストロゲン代謝、免疫と密接に関連し、その結果、子宮内膜症の発症と進行に関与していることを示す研究が増えている。本総説では、子宮内膜症の予防、早期診断、治療に関する新たなアプローチを提供し、子宮内膜症をより深く探求し、研究を拡大するために、腸内細菌叢と密接に関連する子宮内膜症の多様なメカニズムについて議論する。
1 はじめに
子宮内膜症は、一般的なエストロゲン依存性の慢性炎症性婦人科疾患であり、生殖期の女性の6〜10%が罹患すると言われている(Saunders and Horne, 2021)。子宮内膜症は、子宮外で増殖している子宮内膜腺や間質がエストロゲンによって周期的に出血、増殖、線維化を起こし、最終的に女性の健康、生活の質、仕事の生産性に影響を及ぼし、深刻な経済的負担を生じさせると定義されている(Fuldeore et al., 2011)。子宮内膜症は、重症月経困難症、慢性骨盤痛、月経過多、腸・膀胱症状、疲労、抑うつなどの幅広い症状と密接に関連しているため、あるいは、子宮内膜症は症状の異質性が高く、病態の複雑性がますます明らかになっているため、子宮内膜症についてほとんど知られていないため、「症候群」と考えた方がよいかもしれない(Saunders and Horne, 2021)。さらに、非典型的な症状や特異的な診断マーカーがないため、子宮内膜症の確定診断が4~11年遅れることもある(Taylor et al., 2021)。子宮内膜症の治療法には、病巣の外科的切除と卵巣抑制の内科的治療がある。手術後の再発率が高く、薬物による副作用もあるため、病気の治療は厄介な課題である。したがって、免疫、炎症、メタボロミクス、内分泌、骨盤内環境の変化などを含む子宮内膜症の根本的な病態を理解し(Olovsson, 2011)、新たな治療戦略を立案するためには、さらなる研究が必要である。
腸内細菌叢が、身体の免疫、代謝、炎症、ホルモン調節、さらには脳調節に関与し、様々な重要な生物学的プロセスやヒト疾患の発症に重要な役割を果たしていることを示す研究が増えている(Wang et al、 2023年)、炎症性腸疾患(IBD)(Shanら、2022年)、糖尿病(Yangら、2021年)、多嚢胞性卵巣症候群(PCOS)(Liangら、2021年)、卵巣がん(Borellaら、2021年)、うつ病(Simpsonら、2021年;Hongら、2023年)の発生と発症に深く関わっている。サルを対象としたある研究では、子宮内膜症のサルは健康な対照群に比べ、排出される微生物叢のプロフィールが異なり(乳酸菌が少なくグラム陰性菌が多い)、腸内炎症の発生率が高いことがわかった(Bailey and Coe, 2002)。さらに、16S rRNA遺伝子配列決定技術を用いて、子宮内膜症があるマウスとないマウスの糞便細菌を比較した結果、子宮内膜症があるマウスは対照群と様々な分類レベルで異なり、バクテロイデスのレベルが全般的に低下していることが示された(Yuan et al.、2018)。別の研究では、微生物叢欠乏(MD)マウスでは、対照マウスと比較して異所性子宮内膜症病変の増殖が抑制され、子宮内膜症マウスの糞便を経口摂取することで回復することが報告されている(Chadchanら、2023)。正確なメカニズムは不明であるが、子宮内膜症と腸内細菌叢には一定の相関関係がある可能性がある。さらに、腸内微生物はエストロゲンの調節にも関与していることが証明されている(Bakerら、2017)。腸内恒常性の不均衡によって引き起こされる免疫調節異常、炎症反応、エストロゲン代謝異常は、子宮内膜症の増殖を刺激し、子宮内膜症の発症と進行を促進する可能性がある(Hantschelら、2019)。
本総説では、子宮内膜症の複雑な病態をより深く理解し、将来に向けて子宮内膜症の予防、早期診断、治療のためのマイクロバイオームに基づくアプローチを提供することを目的として、腸内細菌叢が関与していると考えられる子宮内膜症の多種多様なメカニズムについて考察する。
2 腸内細菌叢
近年、腸内細菌叢が様々な疾患において重要な役割を果たしていることを示唆する証拠が増えつつある。成人の腸内細菌叢の重さは1kgを超え、その数は100兆個(1014個)にものぼり、ヒトのゲノムコード遺伝子の150倍以上の約500万個の遺伝子をコードしている(D'argenio and Salvatore, 2015)。腸内微生物の分布は、多様性と複雑性を特徴としている。胃から大腸にかけて細菌の数と種類は徐々に増加しており、各部位に分布する優占種も互いに異なっている。大腸は、人体における恒常的な微生物コロニー形成の主要部位である。人体の成長に伴い、体内の腸内細菌叢は変化し続けるが、最終的には安定する(Claesson et al.) 腸内細菌叢では、ファーミキューテス(Firmicutes)属とバクテロイデーテス(Bacteroidetes)属が最も重要な門であり、プロテオバクテリア(Proteobacteria)属、アクチノバクテリア(Actinobacteria)属、フソバクテリア(Fusobacteria)属、ベルコミクロビア(Verrucomicrobia)属がそれに続くと報告されている(Eckburg et al. 腸内細菌叢は、体の成長に必要な各種ビタミン(ビタミンB1、B2、B6、B12、ビタミンKなど)、葉酸、アミノ酸を合成するだけでなく、ミネラル元素の吸収を促進し、複合多糖類、脂肪、胆汁酸などの代謝性食品の消化を助けることができる(Liuら、2021;Duら、2022)。そのほか、血管新生や上皮の修復を促進したり(Ramakrishna, 2013; Schirbel et al., 2013; Abdollahi-Roodsaz et al., 2016)、免疫系の成熟を促進したり(Al-Rashidi, 2022)、脳と腸のコミュニケーションに影響を与えたり(Mayer et al. 腸内微生物の遺伝子変異は、宿主の寿命、睡眠、運動能力も調節する(Liら、2023年)。
腸内細菌叢の組成は、食事、環境暴露、抗生物質の使用など、宿主の特定の行動特性をある程度反映することが研究で示されている(Fourieら、2017)。健康なヒトの腸内細菌、外部環境、宿主の免疫状態は動的なバランスを保っており、これが身体の正常な免疫防御機能の維持に役立っている。バランスが崩れると、通常、細菌種の多様性の低下や病原菌の存在によって現れる腸内細菌異常症となり、消化器疾患や代謝疾患から免疫疾患や精神神経疾患まで、さまざまな疾患を引き起こすことになる(Ratajczak et al.)
3 子宮内膜症の腸内細菌叢
これまでの研究者らは、子宮内膜症の動物モデルや子宮内膜症患者に腸内細菌叢異常があることを示してきた(表1)。しかし、報告された結果の中には完全に一致していないものもある(Iavaroneら、2023;Serら、2023)。子宮内膜症マウスモデルの構築には、雌のC57BL/6 Jマウスが一般的に用いられた。ある研究では、同種マウス子宮内膜の腹腔内注射と21日間の子宮内膜症誘発により子宮内膜症モデルマウスを作製したところ、ファーミキューテス属の存在量が増加し、バクテロイド・オータ属の存在量が減少したと報告している(Niら、2021)。別の研究では、ファーミキューテス類の存在量が減少し、バクテロイデーテス類の存在量が増加するという逆の結論が得られた(Chadchanら、2019年)。さらに別の研究では、同じ方法でマウスの子宮内膜症モデルを作製し、モデル化後42日目まで腸内細菌叢の組成に異常が認められなかった。その結果、子宮内膜症群ではファーミキューテス類が豊富であったのに対し、対照群ではバクテロイデーテス類が豊富であった。ファーミキューテス/バクテロイデスの比率はコントロールの約2倍であった(Yuan et al.) さらに、Hantschelらは、モデル化後21日目では腸内細菌叢組成が子宮内膜症誘導の影響を受けていないようであることを見出し、病変形成の初期段階では腸内細菌叢異常の徴候がないことを示唆しており、これはYuanの結果と一致している(Hantschelら、2019)。上記の動物実験結果には一貫性がなく、これは動物由来、モデル化方法、給餌条件、サンプリング時期の違いに関連している可能性がある。
表1
www.frontiersin.org
表1. 先行研究における子宮内膜症の動物およびヒトにおける腸内細菌叢の変化の特徴。
子宮内膜症患者では、腸内細菌叢のα多様性とβ多様性の両方が有意に減少していた。バクテロイデス(Bacteroides)、パラバクテロイデス(Parabacteroides)、オシロスピラ(Oscillospira)、コプロコッカス(Coprococccus)の存在量が高く、パラプレボテラ(Paraprevotella)、ラクノスピラ(Lachnospira)、ツリシバクター(Turicibacter)の存在量が低いことが検出された(Svenssonら、2021年)。さらに、ステージIII/IVの子宮内膜症患者では、Sneathia、Barnesella、Gardnerellaが属レベルで有意に減少していた(Ata et al.) 別の研究では、ステージIII/IVの子宮内膜症患者では、ファーミキューテス/バクテロイデーテスの比率が増加し、ブラウティア、ビフィドバクテリウム、ドレア、ストレプトコッカスが有意に増加していた(Shanら、2021年)。また、Huangらは、子宮内膜症患者において、Clostridia属Clostridiales、Lachnospiraceae Ruminococcus、Clostridiales Lachnospiraceae、Ruminococcaceae Ruminococcus、Lachnospiraceae Doreaが有意に減少していることを発見した(Huangら、2021)。
これらの研究はいずれも、子宮内膜症患者における腸内細菌叢の変化の特徴的な特徴を見出すことに焦点を当てたものであるが、診断基準、グループ分けの基準、糞便微生物叢の検出方法などに矛盾があるためか、その結果には一致した見解が得られていない。また、腸は複雑な生態系であり、遺伝、食事、年齢、地域差など様々な要因の影響を受ける可能性がある。しかし、上に示した結果はすべて、腸内細菌叢が子宮内膜症と関連していることを示している。その臨床的意義を明らかにするためには、さらなる大規模な臨床研究が必要である。
4 腸内細菌叢が子宮内膜症に関与するメカニズムの可能性
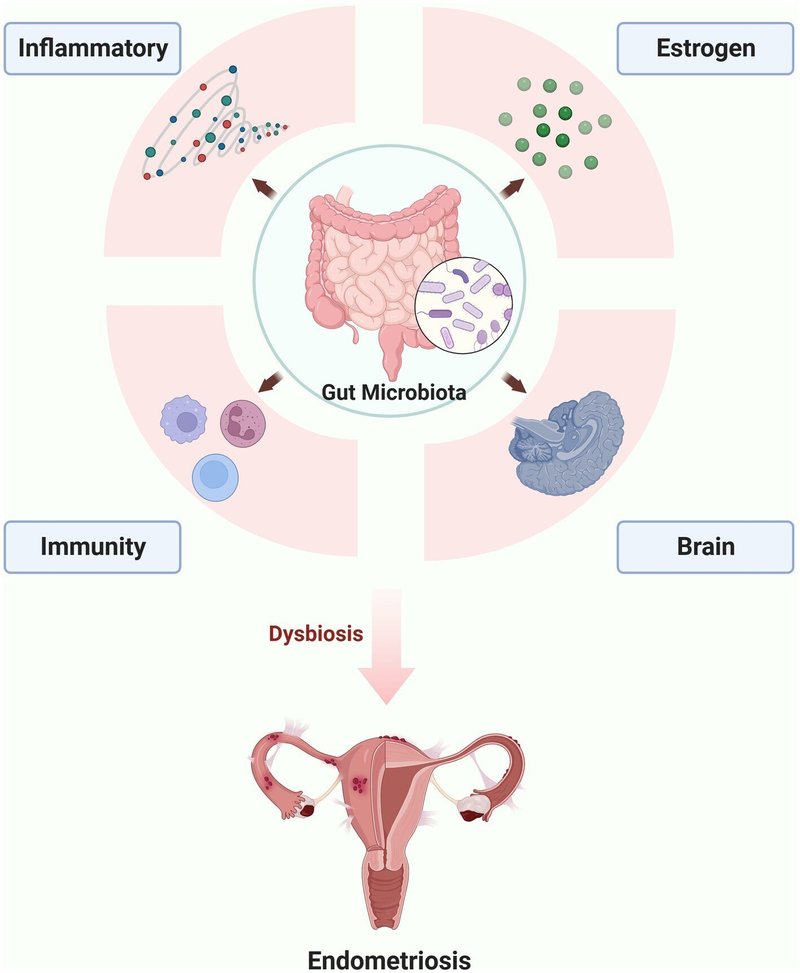
子宮内膜症に腸内細菌叢が関与する根本的なメカニズムを解明するために、免疫、炎症、子宮内膜症におけるエストロゲン-腸内細菌叢軸、および子宮内膜症における腸-脳軸の各側面について、以下のセクションでより詳細に議論する(図1)。
図1
www.frontiersin.org
図1. 子宮内膜症に関与する腸内細菌叢の可能なメカニズム(本総説の図はBioRender.comで作成)。
4.1 免疫
腸は人体で最も免疫細胞が多い臓器の一つである。消化管関連リンパ組織は、腸内での大量の抗原曝露に反応し、適応免疫応答を活性化するよう免疫系を管理することができる。腸内細菌叢は強力な免疫調節能力を有しており、全身の免疫反応を誘導し、腸内微生物生態系の安定性を維持し、病原性細菌の繁殖を抑制し、有害物質を分解して宿主の恒常性を維持することができる。腸管粘膜には多くの微生物が存在し、病原体関連分子パターン(PAMPs)や代謝産物の供給源となっている。リポ多糖(LPS)、ペプチドグリカン、フラジェリン、リポタンパク質などのPAMPsや、短鎖脂肪酸(SCFA)、胆汁酸などの代謝産物が、この側面で重要な役割を果たすことが報告されている(Correa-Oliveira et al.) PAMPsは、パターン認識受容体(PRR)[腸管上皮細胞(IECS)や免疫細胞に広く発現しているToll様受容体(TLR)など(Belizario and Faintuch, 2018)]に結合することで、免疫系と常在細菌叢との相互作用を媒介する。これらの相互作用により、一連の炎症性ケモカイン(IL-8)、サイトカイン(IL-1、IL-6、IL-7、IL-11、TNF)、成長因子(SCF、G-CSF)の分泌が促進される。これらの分子は、末梢好中球や肥満細胞を腸の皮下に動員し、局所リンパ球の活性化と分化を促進する(Zhang C. X. et al., 2019)。しかし、微生物と免疫系の相互作用を説明する分子メカニズムは完全には明らかになっていない。
腸内細菌異常症や細菌の代謝産物は、腸管バリアの破壊、細菌や内毒素の移動、免疫系の調節不全を引き起こし、酸化ストレスや炎症反応をもたらし、それによってさまざまな自己免疫疾患の有病率を高める可能性がある。子宮内膜症は、ポリクローナルB細胞活性化、T細胞、B細胞の機能不全、アポトーシス低下、組織損傷、多臓器病変など、いくつかの自己免疫疾患と特徴を共有しており、子宮内膜症はしばしば自己免疫疾患と関連していることから、多くの研究者が自己免疫疾患と子宮内膜症の関連付けに取り組んできた(Shigesi et al.)
腸内細菌叢は、Tリンパ球の異なるタイプのヘルパーTリンパ球(Th1、Th2、Th17)または制御性Tリンパ球(Treg細胞)への分化に影響を与えることができ、例えば、分節糸状菌(SFB)はTh17分化を直接刺激する(Ivanov et al、 2009;Wangら、2019)、Treg産生誘導に関与するクロストリジウム属菌(Atarashiら、2011)、Th1/Th2バランスの制御に関与するバクテロイデス属菌(Mazmanianら、2005)などである。
多くの研究が、Th17細胞とそのサイトカインプロファイルが子宮内膜症女性の腹膜液で有意に増加しており、Th17細胞からの過剰なIL-17が疾患の重症度に関連していることを示している(Gogaczら、2016;Tarokhら、2019)。Shan Jらは、健康なグループと比較して、ステージIII/IVの子宮内膜症の人々は腸内細菌叢のα多様性が低く、腸内細菌叢異常症の特徴として広く受け入れられているファーミキューテス/バクテロイデーテス比が高いことを発見した。また、子宮内膜症患者ではIL-17Aが有意に減少しており、これは連鎖球菌およびビフィズス菌の存在量と負の相関があることも明らかにした(Shanら、2021年)。Leらは、子宮内膜症を誘発した各ヒヒにおいて、マイクロバイオームの多様性と存在量が変化していることを検出した。子宮内膜症の誘発は、誘発後のすべてのコレクションにおいて、末梢のTregs細胞を減少させる一方でTh17細胞を増加させ、炎症性プロファイルへの免疫シフトと粘膜微生物プロファイルの変化を引き起こした(Le et al.) Treg細胞の量と活性の異常は、体内の免疫微小環境の調節異常、骨盤内免疫機能の低下、免疫逃避を引き起こし、子宮外への異所性子宮内膜の着床と増殖を促進する可能性があることを示唆する証拠が増えている。Chadchanらはまた、微生物叢欠乏(MD)マウスの腹膜には、ビヒクル投与マウスと比較して総マクロファージ数とCD206+(M2様マクロファージ)マクロファージ数が少ないことも観察した。また、CD19+ B細胞、総T細胞、CD4+ T細胞、CD8+ T細胞の数は、MDマウスではビヒクル投与マウスよりも少なかった。これらの結果は、腸内細菌叢が腹膜免疫細胞集団に影響を与えることにより、子宮内膜症の進行を促進することを示唆している(Chadchanら、2023年)。子宮内膜症の発症・進展には、腸内細菌叢異常による免疫反応の異常が関係しているのではないかと推測できる。
4.1.1 LPS
LPSは免疫原性が高く、宿主の強い免疫反応を引き起こすグラム陰性菌の外膜の重要な部分である。腸内細菌叢のバランスが崩れると、グラム陰性菌が大量に増殖し、同時に腸壁の透過性が亢進する。細菌内毒素LPSの漏出は、腸内細菌叢異常と腸管バリア損傷の重要な徴候である(Saad et al.) ある研究では、子宮内膜症マウスから糞便微生物叢を移植すると、マウスの腸壁バリアが破壊され、腹膜LPSレベルが有意に上昇することが明らかになった(Niら、2021年)。一方、別の研究では、子宮内膜症患者の腹腔内で、LPSを放出しうるシュードモナス科シュードモナスとプレボテラ科プレボテラの存在量が増加していることが観察された(Raiaら、2005;Huangら、2021)。
LPSは古典的なToll様受容体シグナル伝達経路を介して働くことができ、Toll様受容体4(TLR4)との結合を介して子宮内膜症の発生と進行を促進することが示されている(Khanら、2010)(図2)。TLR4は細胞の免疫反応や炎症反応を制御するパターン認識受容体で、免疫細胞(マクロファージ、樹状細胞、好中球、ナチュラルキラー細胞など)の細胞膜に広く発現している。LPSが血流やその他の体液中に放出されると、直ちにLPS結合タンパク質に捕捉されてTLR4に送達され、MyD88依存的経路とMyD88非依存的経路の両方を通じてNF-κBを活性化する。活性化されたNF-κBは核内に入り、免疫・炎症反応を引き起こし、TNF-α、IL-8、IL-6などの細胞接着、増殖、抗アポトーシス関連遺伝子の転写を誘発する。
図2
www.frontiersin.org
図2. LPSはToll様受容体4(TLR4)と結合し、NF-κBを活性化することにより、子宮内膜症の発生と進行を促進する。活性化されたNF-κBは核内に入り、TNF-α、IL-8、IL-6などの細胞接着、増殖、抗アポトーシス関連遺伝子の転写を誘発する。これらは自然免疫の活性化により産生され、子宮内膜症発症の重要な一因となる。短鎖脂肪酸(SCFA)は2つのシグナル経路を通じて抗炎症作用を発揮する。第一に、Gタンパク質共役型受容体(GPCR)(GPR41、GPR43、GPR109aなど)を活性化し、Nod様受容体ピリン・ドメイン3(NLRP3)インフラマソームの活性化を阻害することで、炎症性サイトカインの分泌を抑制する。第二に、ヒストン脱アセチル化酵素(HDAC)を阻害して、炎症性腫瘍壊死因子(TNF)の産生を抑制し、核内因子κB(NF-κB)を不活性化することができる(本総説の図はBioRender.comで作成)。
哺乳動物では、自然免疫細胞(マクロファージや樹状細胞など)は細菌性エンドトキシンやLPSによって活性化される。以前の研究では、細菌性エンドトキシンLPSがマクロファージ(Mφ)刺激の潜在的な炎症メディエーターとなり、骨盤内環境において肝細胞増殖因子(HGF)、血管内皮細胞増殖因子(VEGF)、IL-6、TNF-αなどのさまざまなサイトカインや増殖因子を産生する可能性が示された(Khanら、2010)。また、17β-エストラジオールとLPSの併用療法は、子宮内膜症患者の腹膜液中のマクロファージによるIL-6とTNF-αの分泌を促進し、異所性・異所性の子宮内膜細胞の増殖を促進することも見出した。エストロゲン受容体(ER)とTLR4の作用を阻害すると、炎症性サイトカインの分泌と子宮内膜細胞の増殖が有意に抑制される。このことは、エストロゲンとLPSが、骨盤内の炎症反応を促進し、子宮内膜症の増殖を促進するという相加的な効果を持つことを示唆している(Khanら、2015年)。さらに、別の研究では、LPSが卵巣のチョコレート嚢胞内膜から得た子宮内膜間質細胞(ESC)を刺激し、かなりの量のTNF-αとIL-8を産生し、ESCの増殖を促進することが報告されている。抗TNF-α抗体および抗IL-8抗体は、LPSの刺激作用を抑制した。NF-κB阻害剤は、LPS誘発IL-8タンパク質産生とLPS誘発ESCs増殖を有意に減少させた(Iba et al.) このことは、初期炎症メディエーターとして、LPSが骨盤内炎症に関与し、TLR4/NF-κBを介した子宮内膜症の増殖を促進する可能性を示している。したがって、腸内細菌叢の乱れは、宿主の局所的な自然免疫状態に影響を与えることによって、子宮内膜症の発生と発症に影響を与える可能性があると推測される。
4.1.2 短鎖脂肪酸
SCFAは腸内細菌叢が食物繊維を発酵させる際に生じる副産物であり、酢酸塩、プロピオン酸塩、酪酸塩などが含まれる。SCFAは、宿主と腸内細菌にエネルギーを供給するほか、腸内病原菌の侵入に抵抗する、腸管上皮バリアを維持する、宿主の代謝と免疫応答を調節する、抗炎症・抗増殖作用、さらには腫瘍保護作用を高めるなど、さまざまな機能を有している(Zhang Z. et al., 2019; Kimura et al., 2020; Borella et al.) 自然免疫細胞と適応免疫細胞によって構成される腸管上皮バリアは、体内を外部環境から隔離し、微生物の恒常性を維持して炎症を防ぐ。しかし、このバリアが破られると、自然免疫反応と適応免疫反応のメカニズムによって、微生物や組織の修復が引き起こされる。SCFAは腸内マイクロバイオームと免疫系のコミュニケーションにおけるメディエーターとみなされており、常在菌がコロニー形成した腸内で局所的に作用するだけでなく、腸管免疫細胞にも影響を与え、離れた組織の免疫反応を調節する(Fellows et al.)
腸内のSCFAsレベルは、腸内細菌叢の組成に大きく影響される。SCFAは主に2つのシグナル経路を介して働く。第一に、様々な腸内分泌細胞や免疫細胞に存在するGタンパク質共役受容体(GPCR)(GPR41、GPR43、GPR109aなど)を活性化することで、下流の炎症反応を抑制する。第二に、遺伝子の発現制御に関与するヒストン脱アセチル化酵素(HDAC)を阻害することができる。最近のデータでは、SCFAはHDACの阻害によって単核球や好中球に作用し、核内因子κB(NF-κB)の不活性化につながる炎症性腫瘍壊死因子(TNF)の産生を低下させることがわかった(Correa-Oliveiraら、2016;Rooks and Garrett、2016)(図2)。
最近の研究では、子宮内膜症患者の糞便中にLachnospiraceaeのRuminococcusが有意に減少しており、SCAF、特に酪酸の生合成と正の相関があることが明らかになった(Jin et al.) さらに、別の研究では、腸内細菌叢の変化が子宮内膜症病変の成長を促進し、子宮内膜症マウスの糞便は、子宮内膜症でないマウスの糞便よりもSCFAsとn-酪酸の含有量が少なかったと報告している。n-酪酸はGPR43とGPR109Aを介してヒトの子宮内膜症細胞と病変の増殖を抑制した(Chadchanら、2021年)。Lachnospiraceaeルミノコッカスが減少することにより、ヒト腸内のSCFAs濃度が低下し、疾患の発生につながる可能性があると考える。
さらに、マウスモデル研究では、酪酸がNod様受容体ピリン・ドメイン3(NLRP3)インフラマソームの形成と活性化を阻害することで、血管の炎症や動脈硬化を予防できることが示された(Yuanら、2018)。NLRP3インフラマソームは、センサータンパク質であるNLRP3、アダプタータンパク質であるアポトーシス関連斑点様タンパク質(ASC)、炎症性サイトカインであるカスパーゼ-1から構成され、生理活性インターロイキン-1β(IL-1β)やインターロイキン-18(IL-18)などの炎症性サイトカインの分泌を促進する(Strowig et al.) 一方、Hanらは、子宮内膜症患者ではNLRP3が活性化され、IL-1βシグナル伝達を増強し、子宮内膜細胞の接着と増殖を促進し、最終的には異所性病変の形成を促進することを見出した。また、NLRP3欠損マウスでは、異所性病変の体積が対照マウスに比べて大幅に減少することも見いだした(Hanら、2015;Leavy、2015)。このように、酪酸はNLRP3インフラムソームの活性化を抑制することにより、子宮内膜症に対して有益な効果を示す可能性があることを明らかにした。Chadchanらはまた、n-酪酸塩が子宮内膜症細胞の増殖に必要なHDACs活性を阻害することも示した。さらにSamartzisらは、子宮内膜症患者ではHDAC-1の発現が有意に上昇し、ヒストンのアセチル化を阻害することを見出した(Samartzisら、2013年)。まとめると、腸内細菌異常症はn-酪酸の欠乏を引き起こし、子宮内膜症におけるエピジェネティック制御に重要な役割を果たすHDAC-1の発現増加を引き起こすと考えられる。
4.2 炎症性
腸内細菌叢は、身体の代謝経路や免疫反応に変化を引き起こし、局所的、さらには全身的な免疫炎症反応を引き起こし、その結果、身体は長期間にわたって低炎症状態に置かれることになる。子宮内膜症は慢性炎症性疾患であることが広く確認されており、炎症性疾患における腸内細菌叢の役割は、現在では十分に特徴付けられている。最近、ある研究で、広域抗生物質またはメトロニダゾールを投与したマウスでは、子宮内膜症病変の容積が対照マウスに比べて有意に小さく、腹膜液中のIL-1β、TNF-α、IL-6、TGF-β1などの炎症因子が明らかに減少することが示された。メトロニダゾールは、バクテロイデスの増殖を抑えることにより、マウスの子宮内膜症病変の増殖を抑制している可能性がある。また、メトロニダゾールを投与したマウスに子宮内膜症マウスの糞便を与えたところ、子宮内膜症病変の増殖と炎症が回復したこともわかった(Chadchan et al.) 明らかに、この研究は腸内細菌叢が子宮内膜症に関係し、子宮内膜症病変の進行を促進することを示唆した。
Shanらは、ステージIII/IVの子宮内膜症患者における連鎖球菌の存在量が健常人よりも高く、血清IL-8レベルが有意に上昇していることを示した(Shanら、2021)。さらに、これまでの研究で、NF-κB、IL-1、IL-8、シクロオキシゲナーゼ-2(COX-2)などの炎症性サイトカインが、Streptococcus bovisによって誘導的に過剰発現されることが判明している(Abdulamirら、2010)。COX-2の過剰発現は、子宮内膜症の慢性骨盤痛を引き起こす重要な炎症因子であるプロスタグランジンE2(PGE2)の合成を増加させた。このことから、腸内細菌叢を調節することは、子宮内膜症患者の慢性骨盤痛の治療のターゲットとして利用できることがわかる。さらに、COX-2の阻害が子宮内膜症細胞の生存、遊走、浸潤を減少させることが研究で示されている(Banuら、2008年)。Caoらは、子宮内膜症ラットでは、対照群と比較して、ルミノコッカス科植物の存在量が減少していることを発見した(Caoら、2020)。研究では、マウスにおいて、ルミノコッカス科植物と腸上皮細胞のアポトーシスおよびIL-6レベルとの間に負の相関関係があることが示されている(Mengら、2019)。我々は、Ruminococcaceaeの存在量の減少が骨盤の炎症を悪化させる可能性があると推測している。Khanらは、子宮内膜症患者の月経中に大腸菌が存在し、骨盤腔に逆流して腹膜液中のエンドトキシンの増加を引き起こし、これがTLR炎症シグナル伝達経路を活性化して炎症性因子の分泌を刺激すると報告している(Khanら、2010、2012、2014)。TNF-α、IL-6、IL-8などの骨盤腔内の高レベルの炎症性因子は、活性化した腹膜マクロファージの影響を受けて急速に蓄積し、骨盤腔の炎症環境をもたらし、その結果、関連する接着分子の分泌が刺激され、子宮内膜の破片の着床と接着が促進される(Kimら、2012)。このように、微生物が誘発する炎症反応は、子宮内膜破片の異所性接着、着床、浸潤、増殖を促進し、最終的に子宮内膜病変の形成につながる可能性がある。
4.3 子宮内膜症におけるエストロゲン-腸内細菌叢軸
子宮内膜症の病理学的メカニズムはまだ解明されていないが、多くの疫学研究や臨床研究によって、子宮内膜症がエストロゲン依存性の疾患であることが示されている。エストロゲンは、異所性病変の細胞接着、浸潤、増殖を促進し、アポトーシスを抑制し、炎症反応を維持することができる(Ferrero et al.) エストロゲンは、子宮内膜上のエストロゲン受容体(ER)に結合することにより、その生物学的機能を発揮することができる。ERには古典的核内受容体(ERαおよびERβ)と非古典的膜内受容体(GPER1)がある(Borellaら、2021)。ERは活性化された後、プロモーター領域にある特定のDNA配列であるエストロゲン応答エレメント(ERE)に結合したり、核内で他の転写因子と相互作用したりして、標的遺伝子の転写を制御する。さらに、ERは、他の転写因子や応答エレメントとのタンパク質-タンパク質相互作用を通じて、NF-κB、活性化因子タンパク質1(AP-1)、刺激タンパク質-1(SP-1)など、エストロゲンが標的とするERE様配列を欠く遺伝子を制御する。エストロゲンのよく知られたゲノム作用に加えて、非ゲノム作用もある。それらは、ERα、GPER1、マイトジェン活性化プロテインキナーゼ(MAPK)、PI3キナーゼ(PI3K)、cAMPなどを介して働くことができる(Fuentes and Silveyra, 2019)。しかし、子宮内膜症におけるエストロゲンの非遺伝子学的作用についてはまだ議論の余地があり、さらなる研究が必要である。
同時に、腸内細菌叢がエストロゲン代謝に影響を及ぼし、関連疾患を引き起こす可能性があることが実験的研究で示されている(Yangら、2017)(図3)。人体内のエストロゲンは主に卵巣、副腎、脂肪組織から分泌され、肝臓で代謝されるまで血液循環に入る。肝臓でエストロゲンは代謝産物と結合して抱合型エストロゲンとなり、水溶性分子に代謝されて尿や便中に排泄される。腸内細菌叢のアンバランスはβ-グルクロニダーゼを産生し、エストロゲンとグルクロン酸の結合を阻害してエストロゲンの不活性化を抑制し、腸肝循環を通じて循環エストロゲンのレベルを上昇させ、それによって異所性病変の成長を著しく刺激し、子宮内膜症の周期的出血の病理過程に関与する(Plottel and Blaser, 2011; Flores et al., 2012; Shen et al.) これまでの研究で、クロストリジウム属とルミノコッカエ属は脱共役により活性型エストロゲンを産生し、エストロゲン依存性疾患に影響を及ぼすことが報告されている(Bhattら、2017)。Uccelloらは、乳酸桿菌とビフィズス菌が腸内のβ-グルクロニダーゼ産生菌の割合を減らし、エストロゲン再吸収率の低下をもたらし、エストロゲン代謝疾患のリスクを低減することを発見した(Uccello et al.) Shan Jらは、ステージIII/IVの子宮内膜症患者において、BlautiaとDoreaの存在量が有意に増加し、エストロゲンレベルと正の相関があることを発見した(Shanら、2021)。しかし、腸内細菌叢がエストロゲンレベルを上昇させることによって子宮内膜症の発症が促進されるメカニズムについては、まださらなる研究が必要である。
図3
www.frontiersin.org
図3. 子宮内膜症におけるエストロゲン-腸内細菌叢軸。腸内細菌叢の異常はβ-グルクロニダーゼを産生し、これが腸肝循環を通じて循環エストロゲン濃度を上昇させ、子宮内膜症を引き起こす(本総説の図はBioRender.comで作成)。
4.4 子宮内膜症における腸-脳軸
微生物-腸-脳軸(MGB)は、腸内微生物と中枢神経系との間の双方向コミュニケーションを意味し、ますます注目を集めている。この軸は、恒常性を維持する免疫、神経、内分泌、代謝シグナル伝達経路の重要な調節因子と考えられている。MGBの調節異常は、過敏性腸症候群(IBS)(Mayerら、2022年)、うつ病(Averinaら、2020年)、疼痛(Guoら、2019年)、PCOS(Insenserら、2018年;Zhang J.ら、2019年;Liangら、2021年)など、多くの疾患に関与していることが示されている。
微生物叢は、γ-アミノ酪酸(GABA)、ノルエピネフリン、ドーパミン、セロトニンなどを含む神経伝達物質の産生と分泌に様々な影響を与えることができる(Strandwitz, 2018; Yang et al.) これらの神経伝達物質は宿主のホルモンレベルに影響を与える。したがって、腸内細菌叢の組成の変化が宿主のホルモンレベルの変化の原因である可能性がある。腸内細菌は視床下部-下垂体-副腎(HPA)軸の機能と密接な関係がある。これまでの研究で、低コルチゾール血症は子宮内膜症の女性におけるHPA軸の機能不全のバイオマーカーであることが示されている(Petrelluzziら、2008;Quinonesら、2015)。我々は、子宮内膜症における腸内細菌叢の役割は、HPA軸への影響に関連していると推測している。最近の研究では、GABA産生菌の増加がPCOS女性におけるGABAレベルを上昇させ、視床下部のGnRHニューロンの受容体に作用してLHとFSHの分泌に影響を与える可能性があることがわかった(Liangら、2021年)。Salliss氏らは、腸内細菌叢異常症が直接・間接的に視床下部のGnRHニューロンを刺激し、視床下部-下垂体-卵巣(HPO)軸の調節異常をもたらし、GnRH、LH、FSH、エストロゲンなどの性ホルモンの分泌に影響を及ぼすのではないかと考えた。この異常は、最終的には子宮内膜症などのエストロゲン関連疾患に影響を及ぼす可能性がある(Sallissら、2021年)。しかし、上記の子宮内膜症に関する研究領域は、これまであまり掘り下げられてこなかったため、より詳細に調べる価値がある。
さらに、過去数十年にわたり、感情障害が脳内の神経伝達物質のバランスの変化に関係していることが多くの研究で明らかになっている。例えば、大うつ病性障害(MDD)や不安症は、セロトニン系のアンバランスやHPA軸の異常と関連している(Frankiensztajnら、2020年)。これらの疾患は微生物障害とも高い相関がある。不安や抑うつなどの慢性的ストレスは子宮内膜症患者に多く、平均発生率は約41.78%である(Brasil et al.) Xuらは、子宮内膜症患者を、全般性不安障害-7(GAD-7)および患者健康調査票-9(PHQ-9)の質問票によって慢性ストレス群と対照群に分けた。その結果、慢性ストレス群ではコントロール群に比べ、パラプレボテラ属、オドリバクター属、ベヨネラ属、ルミノコッカス属が属レベルで有意に減少していた。また、腸内細菌叢の異常は、腸脳軸の炎症経路を通じて子宮内膜症患者の心理状態に影響を及ぼす可能性があることも示された(Xu et al.) さらに、多くの研究者が、腸内細菌叢異常症がSCFAの減少によってうつ病に重要な役割を果たすことを示している(Dengら、2019)。Silvaらは、SCFAの抗炎症性がうつ病の発症に関係していると考えた(Silvaら、2020)。子宮内膜症患者ではSCFAsのレベルも低下する。SCFAが中枢神経系を直接的・間接的に制御し、最終的に患者の行動や認知機能に影響を与えることを考えると、SCFAがどのように作用しているのかを徹底的に理解する必要がある。SCFAが腸と脳の相互作用にどのように関与しているかを十分に理解することは、子宮内膜症に関連する心理的問題の治療のための新たな標的を同定するのに役立つかもしれない。
MGB軸の提案は、子宮内膜症をよりよく理解し、その病態と治療法を探求するための新たな視点を提供するかもしれない(図4)。しかし、MGB軸と子宮内膜症の病態との因果関係については、さらなる研究が必要である。近年、MGB軸の重要性が広く認識されるようになり、その機能不全は様々な疾患を引き起こす可能性がある(Zhuら、2022年)。このような観点から、子宮内膜症に対する介入や治療標的を見つけることを期待して、多くの研究がMGB軸の生理学的役割を探求している。
図4
www.frontiersin.org
図4. 子宮内膜症における微生物-腸-脳軸(MGB)。微生物叢はSCFAやγ-アミノ酪酸(GABA)などの神経伝達物質の産生・分泌に影響を与え、宿主のホルモンレベルに影響を与える可能性がある。子宮内膜症における腸内細菌叢の役割は、視床下部-下垂体-副腎(HPA)軸および視床下部-下垂体-卵巣(HPO)軸への影響と関連している(本総説の図はBioRender.comで作成)。
5 腸内細菌叢と子宮内膜症の悪性化
1925年、サンプソンは初めて悪性腫瘍と子宮内膜症が同一病変内に共存することを報告した。子宮内膜症は特定の条件や誘因のもとで悪性化を起こす。子宮内膜症の悪性化率は約0.5〜1.0%であり(小林ら、2007;村上ら、2020)、通常は卵巣に発生する。卵巣癌が子宮内膜症に合併し、癌組織が異所性病変に隣接し、異所性子宮内膜から異型過形成、悪性腫瘍へと持続的に変化する場合、"子宮内膜症関連卵巣癌(EAOC)"とみなされる。卵巣明細胞癌(CCC)や卵巣子宮内膜癌の前駆体が子宮内膜症であることは広く認められている。
EAOCの病態は依然として不明である。多くの学者は、腫瘍の本質は炎症過程であると考えている。慢性炎症性疾患や感染症は、世界中の癌の約25%に関与していると報告されている(Hussain and Harris, 2007)。いくつかの研究で、腸内細菌叢ががんの発症に重要な役割を果たしていることが示唆されている(Zhouら、2019;Laborda-Illanesら、2020;Borellaら、2021)など。腸内細菌はTLRをアップレギュレートし、NF-kBを活性化し、IL-6、IL-12、IL-17、IL-18だけでなくTNF-αの放出をもたらし、最終的に腫瘍微小環境における持続的な炎症の引き金となる重要な役割を果たすことができる(Rutkowskiら、2015;Laborda-Illanesら、2020)。Zhouらは、卵巣がん組織では、正常な遠位卵管の組織と比較して、微生物叢の多様性と豊かさの指標が有意に低下していることを発見した。彼らはまた、NF-κBシグナル伝達経路、サイトカイン-サイトカイン受容体相互作用、ケモカインシグナル伝達経路など、炎症関連シグナル伝達経路が卵巣がん組織で劇的に活性化されていることを発見した(Zhouら、2019)。さらにWangらは、LPSが卵巣がん組織に存在することを発見した(Wangら、2020)。LPSはTLR4を刺激してPI3KとMyD88の即時相互作用を引き起こし、AKTのリン酸化をもたらし、最終的に細胞増殖、浸潤、転移を促進する(Parkら、2017)。PI3K/ACT/mTOR経路の異常な活性化は、EAOCを含む腫瘍の悪性化において広く報告されている(Murakamiら、2020)。この経路はCCC治療のバイオマーカーとして注目されている(Yachidaら、2021)。微生物叢は、局所の炎症に影響を与えたり、PI3K/AKT/mTOR経路を刺激したりすることによって、卵巣がんの発生や進行に関与している可能性が示唆された。
さらに、高濃度のエストロゲンは子宮内膜症の悪性化の高リスク因子の一つである。エストロゲンの調節異常は、アロマターゼの発現と活性の増加を通じて、異所性子宮内膜の過形成と悪性化を促進する。上述したように、腸内細菌異常症はエストロゲンの循環レベルを上昇させ、炎症を促進する可能性があり、ひいては、子宮内膜症性インプラントにおける既知のホルモン調節異常とともに、炎症反応が発がんを促進する可能性がある(Dawson et al.) 最後に、腸内細菌叢が子宮内膜症の悪性化に関与している可能性が高いと考えるが、腸内細菌叢が子宮内膜症の悪性化にどのように影響しているかはまだ不明である。子宮内膜症の悪性化のプロセスを細菌叢の調節によって制御できるかどうかを証明するためには、多くの研究が必要である。
6 腸内細菌叢と子宮内膜症に伴う疼痛および不妊症
疼痛は子宮内膜症の主症状であり、主に続発性月経困難症、腰痛、非月経時骨盤痛、CPPとして現れ、子宮内膜症患者の50〜80%に認められる(Taylorら、2021年)。痛みの程度は必ずしも病変の大きさに比例するわけではない。異所性卵巣嚢腫の癒着がひどい患者には痛みがないこともあるが、骨盤内に小さな病変が散在している場合には、通常、患者の日常生活、感情、対人関係、仕事に深刻な影響を及ぼす耐え難い痛みを引き起こすことがある。痛みを軽減し管理することは、子宮内膜症治療の基本的な目標の一つである。近年、子宮内膜症に関連した痛みの研究に対する関心が高まっているが、その病態メカニズムは完全には解明されていない。痛みの制御における腸内細菌叢の新たな役割が注目されるようになり、子宮内膜症関連痛の研究に新たな方向性をもたらしている。
PAMPsは、疼痛条件下における末梢感作の重要な因子であると考えられている。PAMPsは血液循環中に移行し、免疫細胞やDRGの感覚ニューロン上に発現するRPRに結合し、末梢の疼痛感作に関与する(Guo et al.) 腹膜に着床した異所性子宮内膜癒着が異所性病変を形成する過程で、神経血管形成が起こることが研究で示されている(Asante and Taylor, 2011)。子宮内膜症病変部では、侵害受容器としてよく用いられる無髄小神経線維の密度が増加しており、子宮内膜症関連痛の発生と密接な関係があることがわかった(Tokushige et al.) 一方、Liuらは、異所性子宮内膜における一過性受容体電位バニロイド1(TRPV1)陽性神経線維の密度が、対照子宮内膜よりも高く、子宮内膜症女性における月経困難症の重症度と正の相関があることを見出した(Liu et al.) TRPV1は非選択的カチオンチャネルであり、炎症性痛覚過敏に重要な役割を果たしている。TRPV1陽性神経線維の増加は、末梢末端または一次感覚ニューロン上の様々な刺激を統合し、子宮内膜症における痛覚過敏を生じさせる可能性がある(Liuら、2012;Bohonyiら、2017)。さらに、以前の研究では、LPSがTLR4に結合し、TRPV1を介したメカニズムにより、腸内細菌叢に由来する後根神経節(DRG)の侵害受容性ニューロンを活性化し、感作することが見出されている(Diogenes et al.) 腸内細菌叢の異常がLPSの血中への大量流入を引き起こし、TRPV1を活性化してその発現を増加させ、さらに末梢の侵害受容器の感作を促し、子宮内膜症関連痛に関与していると推測できる。一方、PAMPsは免疫細胞などの非神経細胞にも作用し、TNF-α、IL-1β、IL-8などの炎症性サイトカインを放出し、間接的にDRGの一次感覚ニューロンを活性化または感作する。マクロファージと神経線維の両方が子宮内膜症で検出されることは以前に議論された。主にマクロファージから分泌されるTNF-αとIL-1βは、子宮内膜症患者の腹膜液に高発現しており、末梢神経の知覚過敏と痛覚過敏を引き起こす可能性がある(Wuら、2017;Liangら、2018;Maddernら、2020)。このことは、腸内細菌異常症が炎症性サイトカインの放出を促進し、末梢の感作を誘導し、子宮内膜症関連痛に重要な役割を果たしている可能性を示唆している。
子宮内膜症と不妊症には強い相関関係がある。子宮内膜症患者の25~50%が不妊を経験し、不妊患者の最大50%が子宮内膜症に罹患している可能性がある(Bjorkman and Taylor, 2019; Taylor et al.) しかし、子宮内膜症と不妊症の具体的な相互作用機序はまだ明確に解明されていない。腸内細菌叢は、子宮内膜症に関連した不妊症の病態形成に重要な役割を果たしている可能性があるが、あまり研究されていない。子宮内膜症関連不妊症に対する腸内細菌叢の影響は、性ホルモン(Heら、2021年)、アンバランスな免疫プロファイル、炎症促進状態(De Rivero Vaccari、2020年)、および子宮内膜受容性(Bennerら、2018年;Wangら、2021年)の影響によるものと考えられる。最近、2標本のメンデルランダム化(MR)研究により、遺伝的にプロキシされた腸内細菌叢が不妊症に潜在的な因果関係を有することが明らかになったが、これには遺伝的にプロキシされたファミリーXIII AD3011グループ、ルミノコッカス科NK4A214グループ、ベータプロテオバクテリア属、ブルクホルデリア属、カンジダトゥス・ソレアフェレア属、レンティスフェラエ属が含まれる(Zhangら、2023)。子宮内膜症に関連した薬物療法が不妊治療に役立たないことを考えると、腸内細菌叢の介入と治療は、子宮内膜症に関連した不妊治療に大いに期待できる可能性がある。
7 診断
子宮内膜症患者は潜伏期間が長く、非典型的な初期症状や特に限定的ではあるが侵襲的な診断方法のために、診断が4~11年も遅れることがある(Agarwal et al.) 子宮内膜症の診断のゴールドスタンダードは、生検後の組織学的検査を伴う腹腔鏡手術である。しかし、子宮内膜症が疑われるすべての女性にとって、外科的診断は非現実的である。効果的な低侵襲性または非侵襲性のバイオマーカー候補を見つけることが急務である。子宮内膜症と腸内細菌叢に関する研究の増加に伴い、子宮内膜症に関連する候補微生物の発見は、診断的価値の可能性を秘めている。子宮内膜症の女性またはマウスモデルにおいて、いくつかの腸内微生物の異常が同定されている。Huangらは、患者の糞便中のLachnospiraceae Ruminococcusの減少が、子宮内膜症のバイオマーカーとなる可能性があることを明らかにした(Huangら、2021年)。ある研究では、ステージIII/IVの子宮内膜症患者14人のうち2人が、腸内細菌叢がエシェリヒア属/シゲラ属に支配されていることが判明し、これらの患者のさらなる追跡調査では、重度の腸病変が認められ、分節性大腸切除術を受けた。しかし、対照群の患者の腸内細菌叢は同様の構成を示さなかった。このことから、腸内細菌叢解析は腸切除を予測する方法となりうることが推測される(Ata et al.) 2標本のメンデルランダム化(MR)研究により、合計8つの腸内細菌叢分類群が子宮内膜症と関連していることが確認され、そのうち、クラス-メライナバクテリア、科-ルミノコッカス科、属-Eubacteriumruminantiumは子宮内膜症の予防効果があり、目-バチルス目、科-プレボテラ科、属-Anaerotruncus、属-Olsenella、属-ルミノコッカス科UCG002は子宮内膜症のリスクを増加させる可能性がある。これらの分類群は、子宮内膜症の間接的診断に使用できる可能性がある(Ji et al.)
腸内細菌叢が、腸内細菌叢由来の代謝産物を通じて子宮内膜症に影響を及ぼす可能性があることを示す証拠がますます増えており、子宮内膜症の早期診断に新たな方向性を与えている。Chadchanらは、子宮内膜症マウスの糞便中で、細胞増殖と子宮内膜症病変の成長を促進する可能性のあるキナ酸が有意にアップレギュレートされていることを発見した(Chadchanら、2023)。Niらはまた、子宮内膜症マウスの糞便メタボロミクスにおいて、チェノデオキシコール酸(CDCA)、ウルソデオキシコール酸(UDCA)、ALA、および12,13 s-エポキシ-9z, 11, 15zオクタデカトリエン酸(12,13-EOTrE)と名付けられた4つの重要な微分代謝産物をスクリーニングしており、これらは近い将来、子宮内膜症の非侵襲的診断および治療のための潜在的バイオマーカーとして使用することができる(Niら、2020)。子宮内膜症の診断におけるマイクロバイオームと代謝産物の重要性を明らかにするためには、さらなる研究が必要である。
8 治療
子宮内膜症に対する現在の治療法には、卵巣抑制の内科的治療と病巣の外科的切除がある。非ステロイド性抗炎症薬(NSAIDs)、経口避妊薬、黄体ホルモン、GnRHアナログ、アロマターゼ阻害薬、アンドロゲンアナログは、子宮内膜症の長期管理に広く臨床応用されているが、根治的ではない。外科的切除後の再発率が高いため、理想的には子宮内膜症の全生涯で1回が強調されるべきであるにもかかわらず、手術は通常何度も繰り返される。手術後の再発率の高さと薬剤の副作用を考慮すると、子宮内膜症における以下の潜在的な治療アプローチを探求するために、さらなる研究が必要である。
8.1 プロバイオティクス
プロバイオティクスは、ヒトの消化器系に定着し、宿主の微生物学的バランスを促進する活性微生物の一種である。プロバイオティクスは主に乳酸桿菌とビフィズス菌で構成され、腸上皮の完全性を高め、腸バリアを保護し、消化管粘膜の免疫系を調節し、病原性細菌の増殖を抑制することができる(Kim et al.) プロバイオティクスは研究のホットスポットとなっており、多くの疾患の治療に有益な効果をもたらしている(Yang et al.)
腸内細菌叢の種類と存在量、ならびにヒト免疫細胞と免疫分子を変化させるプロバイオティクス介入は、子宮内膜症治療の新たな標的として大きな可能性を秘めている。伊藤博之らは、プロバイオティクス乳酸菌の一つであるラクトバチルス・ガセリOLL2809が、マウスにおいてNK細胞の活性化を介して子宮内膜症の発症を抑制することを見出した(Itoh et al.) さらに、無作為化二重盲検プラセボ対照試験では、L. gasseri OLL 2809を含む錠剤が、子宮内膜症患者において月経痛および月経困難症を改善し、副作用がないことが示された(Itoh et al.) 試験的無作為化三重盲検プラセボ対照試験では、経口乳酸菌が子宮内膜症に関連する痛みを有意に緩和することがわかった(Khodaverdi et al.) 前述の研究は、プロバイオティクスが子宮内膜症の進行を抑制するだけでなく、明らかな副作用を伴わずに子宮内膜症に伴う疼痛緩和に有益であることを示唆した。経口避妊薬と非ステロイド性抗炎症薬(NSAIDs)の併用(月経困難症を予防するための連続投与)、または黄体ホルモンとNSAIDsの併用が、子宮内膜症に伴う疼痛に対する第一選択療法であったが、これらはしばしば重大で好ましくない副作用を伴う(Taylorら、2021年)。手術後の子宮内膜症関連疼痛の再発率は40~50%と高い(Vercellini et al.) プロバイオティクスは、子宮内膜症関連痛の新たな治療ターゲットとして大きな可能性を秘めている。しかし、子宮内膜症におけるプロバイオティクス療法の役割を調べるためには、前臨床および臨床研究が必要である。
8.2 食事療法
子宮内膜症患者に対する食事介入や食事療法の治療的可能性は、補完療法や自己管理としてますます注目されている。食事は宿主と腸内微生物が共有する基質であり、腸内細菌叢の組成と代謝活性を変化させることができる。オメガ3多価不飽和脂肪酸(Omega-3 PUFAs)は、ヒトが食事から摂取すべき必須脂肪酸で、主に魚類、海藻類、ナッツ類から摂取し、ドコサヘキサエン酸(DHA)、エイコサペンタエン酸(EPA)、α-リノレン酸(ALA)、ドコサペンタエン酸(DPA)など、腸管免疫の調節や腸管恒常性の維持に関与している。オメガ3系PUFAは腸内微生物群集に影響を与える可能性がある。以前の研究では、オメガ3 PUFAはLPS産生菌(大腸菌など)を減少させる一方で、LPS抑制菌(ビフィズス菌など)を増加させ、炎症性サイトカイン(TNF-α、IL-1β、IL-6)の減少につながると報告されている(Kaliannanら、2015)。オメガ3系PUFAが子宮内膜症を抑制する効果があることを示唆する証拠が増えつつある。動物実験では、オメガ3系PUFAは抗炎症作用を介して子宮内膜症の発症を抑制することが示唆された(Tomioら、2013;Attamanら、2014)。閉経前の女性を対象とした前向き研究では、オメガ3系PUFAの長期摂取により子宮内膜症の発症率が低下することが示された(Missmerら、2010年)。ALAはオメガ3系PUFAsの一種で、植物油の種子に多く含まれている。ALAの量は、腸内細菌症の影響を受けた子宮内膜症マウスの糞便中で有意に減少していた(Niら、2020)。ALA の外因性補給は、子宮内膜症マウスの Lactobacillus、Bacteroides、Muribaculum、 Clostridium_ sensu_ stricto_ 1、および Bifidobacterium の存在量を明らかに改善し、腹腔内の LPS レベルと腹膜マクロファージの凝集を減少させることができた (Ni et al., 2021)。ウサギの子宮内膜症モデルにおいて、ALAの補給はPGE2の濃度と子宮内膜症病変の直径を減少させることができた(Covens et al., 1988)。オメガ3系PUFAによる腸内細菌叢の調節が、子宮内膜症の予防と治療に寄与する可能性が推測される。
さらに、低FODMAPと呼ばれる食事療法は、発酵性オリゴ、ジ、単糖、ポリオールの少ない食事であり、腸内細菌叢とその代謝産物の多様性を変化させる可能性がある。低FODMAP食は、腸内細菌組成を調節することで便中LPSを減少させ、腸管バリア機能を改善する可能性がある(Zhou et al.) 過敏性腸症候群(IBS)の治療において、潜在的な腸内細菌関連経路を介したこの食事介入の有効性を示した研究もある(Hustoftら、2017;Suら、2019;Milajerdiら、2020)。子宮内膜症患者は胃腸症状の発生率が高く、最大90%であり、子宮内膜症と診断される前にIBSに罹患していることが多い(Seamanら、2008;Marounら、2009)。コホート研究のレトロスペクティブ分析では、低FODMAP食が子宮内膜症の女性の腸症状の軽減に有益であることが判明している(Mooreら、2017)。この食事介入は、子宮内膜症の消化器症状を緩和する新たなアプローチになるかもしれない。別の研究によると、低FODMAP食を3週間摂取したところ、IBS患者の症状は一貫して改善したが、糞便細菌(アクチノバクテリア、ビフィズス菌、フェカリバクテリウム・プラウスニッツイ)、総SCFA、n-酪酸は著しく減少し、腸の健康に劇的な影響を与えた(Hustoftら、2017年)。このような問題を回避するために、低FODMAP食による治療後に除去食を選択的に再導入することが推奨されている(Mayerら、2022年)。しかし、子宮内膜症患者における低FODMAP食にはさらなる研究が必要である。食事は腸内細菌叢の構成に影響を及ぼし、それを調節する主な因子のひとつであるため、食事が腸内細菌叢にどのような影響を及ぼすかを理解することは重要である。その正確なメカニズムはまだ不明であるが、食事介入は子宮内膜症の重要な補助的治療法である。
8.3 糞便微生物叢移植
FMTとは、健康なドナーの糞便懸濁液を被験者に移植することである。FMTは腸内細菌叢の障害を直接改善し、IBS(Johnsenら、2018年)、潰瘍性大腸炎(Dingら、2019年)、うつ病(Dollら、2022年)、メタボリックシンドローム(Kootteら、2017年)などの一連の微生物介在性疾患に対する新たな治療経路を開発することができる。FMTはクロストリジウム・ディフィシル感染症(CDI)の治療において広く認知されており、再発難治性CDIに対するFMTの有効率は90%以上であり、副作用もほとんどない(Quraishi et al.) しかし、子宮内膜症の治療におけるFMTの実験的報告は現在のところなく、さらなる検討が必要である。
9 限界と今後の方向性
現在進行中の研究の多くは、腸内細菌叢と子宮内膜症との相関に焦点が当てられているが、その根底にあるメカニズムを解明するためには、さらなる系統的な研究が必要である。現代のゲノム解読技術の急速な発展は、短期間のうちに研究者の微小生物に対する理解を一変させた。しかし、腸内細菌叢は数が多く、組成も複雑であるため、研究者は腸内のすべての微生物に関するデータを正確に把握することができず、検出されていない、あるいは存在量の少ない細菌種を無視してしまう可能性がある。したがって、腸内細菌叢と微生物由来の代謝産物に関する研究がさらに進めば、子宮内膜症に対する理解が深まるだけでなく、この分野における新たな治療法となる理論的根拠が得られるだろう。子宮内膜症は組織学的に、表在性腹膜子宮内膜症、深部浸潤性子宮内膜症、卵巣(嚢胞)子宮内膜症の3つに細分化されるが、子宮内膜症病変は単独で存在するわけではなく、広範な病変が不均一な臨床症状を併発し、最終的には疼痛や不妊症につながる。今後は、骨盤痛が主症状であるか、不妊症が主症状である子宮内膜症において、特定の微生物叢組成または微生物叢が介在する代謝産物が子宮内膜症を制御するメカニズムをさらに解明し、より早く、より安全で、より感度の高い診断方法と、より効果的な治療法を探索する必要がある。そのほか、シングルセルRNAシーケンスの解析フレームワーク(Hu et al、 2023)、常に更新されるマイクロバイオーム遺伝子データベース、腸内細菌叢の薬物代謝と生体内変換、決定された特定の腸内細菌叢組成と組み合わせることで、早期スクリーニングに活用できる可能性があり、また子宮内膜症の重症度に応じてリスク層別化し、タイムリーな介入と的確な治療につなげることができる。再発率の高い外科的治療や重篤な副作用を伴う内科的治療が現在行われていることを考慮すると、微生物学的同定後に特定の微生物を標的とする新規介入法を開発することで、治療による潜在的な副作用を軽減し、子宮内膜症に対する効果的な全身療法を提供できる可能性がある。
著者貢献
CG:原案執筆。CZ:監修、執筆-校閲・編集、概念化、形式的解析、検証、視覚化。
資金提供
著者は、本論文の研究、執筆、および/または出版のために金銭的支援を受けていないことを宣言する。
利益相反
著者らは、潜在的な利益相反と解釈されるような商業的または金銭的関係がない中で研究が行われたことを宣言する。
発行者注
本論文で表明された主張はすべて著者個人のものであり、必ずしも所属団体や出版社、編集者、査読者の主張を代表するものではない。本記事で評価される可能性のあるいかなる製品、またはその製造元が主張する可能性のある主張も、出版社によって保証または支持されるものではない。
略語
NLRP3, Nucleotide oligomerization domain-like receptor protein 3; MAMP, Microbe-associated molecular pattern; TLR, Toll-like receptor; SCFA, Short chain fatty acid; TNF-α, Tumor necrosis factor alpha.
参考文献
Abdollahi-Roodsaz, S., Abramson, S. B., and Scher, J. U. (2016). The metabolic role of the gut microbiota in health and rheumatic disease: mechanism and interventions. Nat. Rev. Rheumatol. 12, 446-455. doi: 10.1038/nrheum.2016.68
PubMed Abstract|フルテキスト|Google Scholar
Abdulamir, A. S., Hafidh, R. R., and Bakar, F. A. (2010). 大腸腫瘍にコロニー形成するStreptococcus gallolyticus細菌の分子検出、定量化、分離:IL-1、COX-2、IL-8を介した炎症による発癌の可能性。Mol. Doi:10.1186/1476-4598-9-249。
PubMedアブストラクト|全文|Google Scholar
Agarwal, S. K., Chapron, C., Giudice, L. C., Laufer, M. R., Leyland, N., Missmer, S. A., et al. 子宮内膜症の臨床診断:行動への呼びかけ。Am. J. Obstet. Gynecol. 220, 354.e1-354.e12. doi: 10.1016/j.ajog.2018.12.039
フルテキスト|Google Scholar
Al-Rashidi, H. E. (2022). eubiosis and dysbiosisにおける腸内細菌叢と免疫の関連性。Saudi J. Biol. この論文では、腸内細菌叢と免疫の関連性を明らかにした。
パブコメ抄録|全文|Google Scholar
Asante, A., and Taylor, R. N. (2011). 子宮内膜症:神経血管新生の役割。Annu. この論文では、子宮内膜症における神経血管新生の役割について検討した。
PubMedアブストラクト|フルテキスト|Google Scholar
Ata, B., Yildiz, S., Turkgeldi, E., Brocal, V. P., Dinleyici, E. C., Moya, A., et al. エンドバイオスタ研究:ステージ3/4の子宮内膜症女性と健常対照者の膣、子宮頸部、腸内細菌叢の比較。Sci. Rep. 9:2204. doi: 10.1038/s41598-019-39700-6
PubMedアブストラクト|フルテキスト|Google Scholar
大腸制御性T細胞の誘導。クロストリジウム属常在菌による大腸制御性T細胞の誘導。科学 331, 337-341.
PubMedアブストラクト|フルテキスト|Google Scholar
Attaman, J. A., Stanic, A. K., Kim, M., Lynch, M. P., Rueda, B. R., and Styer, A. K. (2014). 子宮内膜症様病変の形成過程におけるオメガ3多価不飽和脂肪酸の抗炎症作用。Am. J. Reprod. Immunol. 72, 392-402. doi: 10.1111/aji.12276
PubMedアブストラクト|全文|Google Scholar
Averina, O. V., Zorkina, Y. A., Yunes, R. A., Kovtun, A. S., Ushakova, V. M., Morozova, A. Y., et al. うつ病と相関するヒト腸内細菌叢の細菌代謝産物。Int. J. Mol. Sci. 21:9234. doi: 10.3390/ijms21239234.
Google Scholar
Bailey, M. T., and Coe, C. L. (2002). 子宮内膜症は、メスのアカゲザルにおける腸内細菌叢のプロファイルの変化と関連している。Hum. Reprod. 17, 1704-1708. doi: 10.1093/humrep/17.7.1704
PubMedアブストラクト|全文|Google Scholar
Baker, J. M., Al-Nakkash, L., and Herbst-Kralovetz, M. M. (2017). エストロゲン-腸内マイクロバイオーム軸: 生理学的および臨床的意義。Maturitas 103, 45-53. doi: 10.1016/j.maturitas.2017.06.025.
PubMedアブストラクト|フルテキスト|Google Scholar
Banu, S. K., Lee, J., Speights, V. O. Jr., Starzinski-Powitz, A., and Arosh, J. A. (2008). シクロオキシゲナーゼ-2は、複数の機序によりヒト子宮内膜症細胞の生存、遊走、浸潤を制御する。内分泌学 149, 1180-1189.
PubMed Abstract|フルテキスト|Google Scholar
Belizario, J. E., and Faintuch, J. (2018). マイクロバイオームと腸内細菌異常症。Exp. Suppl. doi: 10.1007/978-3-319-74932-7_13.
全文|Google Scholar
Benner, M., Ferwerda, G., Joosten, I., and Van Der Molen, R. G. (2018). 子宮内細菌叢はどのように受容的で受胎可能な子宮内膜に関与しているかもしれない。Hum. Reprod. Update 24, 393-415. doi: 10.1093/humupd/dmy012
PubMedアブストラクト|全文|Google Scholar
Bhatt, A. P., Redinbo, M. R., and Bultman, S. J. (2017). がんの発生と治療におけるマイクロバイオームの役割。CA Cancer J. Clin. 67, 326-344. doi: 10.3322/caac.21398.
PubMedアブストラクト|フルテキスト|Google Scholar
Bjorkman, S., and Taylor, H. S. (2019). 子宮内膜症におけるマイクロRNA:生物学的機能と新たなバイオマーカー候補†.Biol. Reprod. 101, 1167-1178. doi: 10.1093/biolre/ioz014.
PubMedアブストラクト|全文|Google Scholar
Bohonyi, N., Pohoczky, K., Szalontai, B., Perkecz, A., Kovacs, K., Kajtar, B., et al. 直腸S状結腸深浸潤性子宮内膜症における一過性受容体電位アンキリン1および一過性受容体電位バニロイド1イオンチャネルの局所的発現上昇。Mol. 疼痛13:1744806917705564.
PubMedアブストラクト|フルテキスト|Google Scholar
Borella,F.、Carosso,A. R.、Cosma,S.、Preti,M.、Collemi,G.、Cassoni,P.、他(2021年)。腸内細菌叢と婦人科がん:発症機序のまとめと今後の方向性。ACS Infect. Dis. 7, 987-1009. doi: 10.1021/acsinfecdis.0c00839
PubMedアブストラクト|フルテキスト|Google Scholar
Brasil, D. L., Montagna, E., Trevisan, C. M., La Rosa, V. L., Lagana, A. S., Barbosa, C. P., et al. 子宮内膜症女性における心理的ストレスレベル:観察研究の系統的レビューとメタアナリシス。Minerva Med. 111, 90-102. doi: 10.23736/S0026-4806.19.06350-X
PubMedアブストラクト|フルテキスト|Google Scholar
Cao, Y., Jiang, C., Jia, Y., Xu, D., and Yu, Y. (2020). レトロゾールと伝統的漢方薬である少婦珠湯煎はラットにおける子宮内膜症性疾患の進行を抑制する:腸内細菌叢の潜在的役割。Evid. Based Complement. Alternat. Med. 2020、3687498-3687414。
PubMedアブストラクト|フルテキスト|Google Scholar
Chadchan, S. B., Cheng, M., Parnell, L. A., Yin, Y., Schriefer, A., Mysorekar, I. U., et al. メトロニダゾールによる抗生物質療法は、マウスにおける子宮内膜症の疾患進行を抑制する:腸内細菌叢の潜在的役割。Hum. Reprod. 34, 1106-1116. doi: 10.1093/humrep/dez041
PubMedアブストラクト|全文|Google Scholar
Chadchan, S. B., Naik, S. K., Popli, P., Talwar, C., Putluri, S., Ambati, C. R., et al. 腸内細菌叢と微生物叢由来代謝産物は子宮内膜症を促進する。Cell Death Discov. 9:28. doi: 10.1038/s41420-023-01309-0
PubMedアブストラクト|フルテキスト|Google Scholar
Chadchan, S. B., Popli, P., Ambati, C. R., Tycksen, E., Han, S. J., Bulun, S. E., et al. 腸内細菌叢由来の短鎖脂肪酸は子宮内膜症の進行を防ぐ。ライフサイ・アライアンス4:e202101224.
PubMedアブストラクト|フルテキスト|Google Scholar
Claesson, M. J., Cusack, S., O'sullivan, O., Greene-Diniz, R., De Weerd, H., Flannery, E., et al. 高齢者の腸内細菌叢の組成、変動性、時間的安定性。Proc. Natl. Acad. 米国108, 4586-4591.
PubMedアブストラクト|フルテキスト|Google Scholar
Correa-Oliveira, R., Fachi, J. L., Vieira, A., Sato, F. T., and Vinolo, M. A. (2016). 短鎖脂肪酸による免疫細胞機能の制御。Clin. Transl. Immunol. 5:e73. doi: 10.1038/cti.2016.17
PubMedアブストラクト|フルテキスト|Google Scholar
Covens, A. L., Christopher, P., and Casper, R. F. (1988). ウサギの手術誘発子宮内膜症に対する食餌性魚油脂肪酸補給の効果。Fertil. Steril. 49, 698-703. doi: 10.1016/s0015-0282(16)59842-2
PubMedアブストラクト|全文|Google Scholar
D'argenio, V., and Salvatore, F. (2015). 健康な成人の状態における腸内細菌叢の役割。Clin. Chim. Acta 451, 97-102. doi: 10.1016/j.cca.2015.01.003
全文|Google Scholar
Dawson, A., Fernandez, M. L., Anglesio, M., Yong, P. J., and Carey, M. S. (2018). Endometriosis and endometriosis-associated cancers: new insights into the molecular mechanisms of ovarian cancer development. doi: 10.3332/ecancer.2018.803.
PubMed Abstract|フルテキスト|Google Scholar
De Rivero Vaccari, J. P. (2020). 生殖生物学におけるインフラマソーム: 新規治療の有望な標的。Front. Endocrinol. (ローザンヌ)11:8. doi: 10.3389/fendo.2020.00008
PubMedアブストラクト|フルテキスト|Google Scholar
Deng, F. L., Pan, J. X., Zheng, P., Xia, J. J., Yin, B. M., Liang, W. W., et al. Metabonomics reveals peripheral and central short-chain fatty acid and amino acid dysfunction in a natural occurring depressive model of macaques. Neuropsychiatr. Dis. Treat. 15, 1077-1088. doi: 10.2147/NDT.S186071
パブコメ抄録|全文|Google Scholar
Ding, X., Li, Q., Li, P., Zhang, T., Cui, B., Ji, G., et al. 活動性潰瘍性大腸炎における糞便微生物叢移植の長期安全性と有効性。Drug Saf. 42, 869-880. doi: 10.1007/s40264-019-00809-2
PubMed Abstract|フルテキスト|Google Scholar
Diogenes, A., Ferraz, C. C., Akopian, A. N., Henry, M. A., and Hargreaves, K. M. (2011). LPSは、三叉神経感覚ニューロンのTLR4の活性化を介してTRPV1を感作する。J. Dent. このことは、三叉神経知覚ニューロンにおけるTLR4の活性化を介してTRPV1を感作することを示唆している。
PubMedアブストラクト|フルテキスト|Google Scholar
Doll, J. P. K., Vazquez-Castellanos, J. F., Schaub, A. C., Schweinfurth, N., Kettelhack, C., Schneider, E., et al. うつ病の補助療法としての糞便微生物叢移植(FMT)-症例報告。Front. Psych. doi: 10.3389/fpsyt.2022.815422.
Google Scholar
Du, Y., Li, D. X., Lu, D. Y., Zhang, R., Zheng, X. X., Xu, B. J., et al. 高脂肪・高ショ糖食+低用量ストレプトゾトシンにより誘導されたマウスにおいて、Morus alba L.水抽出物は腸内細菌叢と糞便メタボロームを変化させる。Phytother. (株)日本農芸化学会誌, 36, 1241-1257.
パブコメ要旨|全文|Google Scholar
Eckburg, P. B., Bik, E. M., Bernstein, C. N., Purdom, E., Dethlefsen, L., Sargent, M., et al. ヒト腸内微生物叢の多様性。科学 308, 1635-1638.
PubMedアブストラクト|フルテキスト|Google Scholar
Fellows, R., Denizot, J., Stellato, C., Cuomo, A., Jain, P., Stoyanova, E., et al. 微生物叢由来の短鎖脂肪酸は、ヒストン脱アセチル化酵素を介して大腸のヒストンクロトン化を促進する。Nat. Commun. 9:105. doi: 10.1038/s41467-017-02651-5
PubMedアブストラクト|フルテキスト|Google Scholar
Ferrero, S., Remorgida, V., Maganza, C., Venturini, P. L., Salvatore, S., Papaleo, E., et al. アロマターゼと子宮内膜症:エストロゲンが果たす役割。Ann. N. Y. Acad. Sci. 1317, 17-23. doi: 10.1111/nyas.12411
PubMedアブストラクト|フルテキスト|Google Scholar
Flores, R., Shi, J., Fuhrman, B., Xu, X., Veenstra, T. D., Gail, M. H., et al. 便中および全身性エストロゲンとエストロゲン代謝産物の便中微生物決定因子:横断研究。J. Transl. Med. 10:253. doi: 10.1186/1479-5876-10-253
PubMedアブストラクト|フルテキスト|Google Scholar
Fourie, N. H., Wang, D., Abey, S. K., Creekmore, A. L., Hong, S., Martin, C. G., et al. ストレス誘発性過敏性腸症候群モデルにおけるラットの大腸マイクロバイオームの構造的および機能的変化。Gut Microbes 8, 33-45. doi: 10.1080/19490976.2016.1273999
PubMedアブストラクト|フルテキスト|Google Scholar
Frankiensztajn, L. M., Elliott, E., and Koren, O. (2020). 微生物叢と視床下部-下垂体-副腎皮質(HPA)軸、不安障害とストレス障害への影響。Curr. Opin. Neurobiol. 62, 76-82. doi: 10.1016/j.conb.2019.12.003
PubMedアブストラクト|フルテキスト|Google Scholar
Fuentes, N., and Silveyra, P. (2019). エストロゲン受容体シグナル伝達機構。Adv. Protein Chem. Struct. doi: 10.1016/bs.apcsb.2019.01.001.
PubMedアブストラクト|フルテキスト|Google Scholar
Fuldeore, M., Chwalisz, K., Marx, S., Wu, N., Boulanger, L., Ma, L., et al. 新たに子宮内膜症と診断された女性における手術手技とその費用見積もり:米国のデータベース研究。J. Med. J. Med. 14, 115-123. doi: 10.3111/13696998.2010.549532.
PubMedアブストラクト|フルテキスト|Google Scholar
Gao, H., Sun, J., Wang, Y., Lu, Y., Liu, L., Zhao, Q., et al. オートエンコーダと非負行列因数分解に基づく代謝物と疾患の関連性の予測。Brief. Bioinform. 24:bbad259。
PubMedアブストラクト|全文|Google Scholar
Gogacz, M., Winkler, I., Bojarska-Junak, A., Tabarkiewicz, J., Semczuk, A., Rechberger, T., et al. 腹水中のTh17細胞の割合の増加は、子宮内膜症の重症度と関連している。J. Reprod. Immunol. doi: 10.1016/j.jri.2016.04.289.
PubMed Abstract|フルテキスト|Google Scholar
Guo, R., Chen, L. H., Xing, C., and Liu, T. (2019). 腸内細菌叢による疼痛調節:分子メカニズムと治療の可能性。Br. J. Anaesth. 123, 637-654. doi: 10.1016/j.bja.2019.07.026
PubMedアブストラクト|フルテキスト|Google Scholar
Han, S. J., Jung, S. Y., Wu, S. P., Hawkins, S. M., Park, M. J., Kyo, S., et al. エストロゲン受容体ベータは、アポトーシス複合体およびインフラマソームを調節し、子宮内膜症の病態を促進する。Cell 163, 960-974. doi: 10.1016/j.cell.2015.10.034
PubMedアブストラクト|フルテキスト|Google Scholar
Hantschel, J., Weis, S., Schafer, K. H., Menger, M. D., Kohl, M., Egert, M., et al. 病変形成の急性期におけるマウスの糞便細菌叢組成に対する子宮内膜症の影響。PLoS One 14:e0226835. doi: 10.1371/journal.pone.0226835.
PubMedアブストラクト|フルテキスト|Google Scholar
He,S.、Li,H.、Yu,Z.、Zhang,F.、Liang,S.、Liu,H.、他(2021年)。腸内細菌叢と性ホルモン関連疾患。Front. Microbiol. doi: 10.3389/fmicb.2021.711137.
PubMedアブストラクト|フルテキスト|Google Scholar
(2023)。レピジウム・メエニイ(Lepidium meyenii)。Lepidium meyenii Walp(マカ)由来細胞外小胞は、腸脳軸の調節を介して5-HT合成を促進することにより、うつ病を改善する。
Google Scholar
Hu, H., Feng, Z., Lin, H., Cheng, J., Lyu, J., Zhang, Y., et al. シングルセル・マルチオミクスデータに基づく遺伝子機能と細胞表面タンパク質の関連解析。Comput. Biol. Med. 157:106733. doi: 10.1016/j.compbiomed.2023.106733.
PubMedアブストラクト|フルテキスト|Google Scholar
Huang, L., Liu, B., Liu, Z., Feng, W., Liu, M., Wang, Y., et al. 子宮内膜症の早期診断には、腸内細菌叢が子宮頸部細菌叢を上回る。Front. Cell. Infect. Microbiol. 11:788836. doi: 10.3389/fcimb.2021.788836
PubMedアブストラクト|フルテキスト|Google Scholar
Hussain, S. P., and Harris, C. C. (2007). 炎症と癌:新たな可能性を秘めた古くからのつながり。Int. J. Cancer 121, 2373-2380.
PubMedアブストラクト|フルテキスト|Google Scholar
Hustoft, T. N., Hausken, T., Ystad, S. O., Valeur, J., Brokstad, K., Hatlebakk, J. G., et al. 過敏性腸症候群患者の症状、糞便微小環境、サイトカインプロファイルに対する発酵性短鎖炭水化物の食事含量の変化の影響。Neurogastroenterol. Motil. 29, 1-9. doi: 10.1111/nmo.12969
PubMedアブストラクト|フルテキスト|Google Scholar
Iavarone, I., Greco, P. F., La Verde, M., Morlando, M., Torella, M., De Franciscis, P., et al. 子宮内膜症における腸内細菌組成と病態生理学的および外科的側面との相関:文献のレビュー。論文タイトル:「子宮内膜症における腸内細菌組成、病態生理学的および外科的側面の相関:文献のレビュー」(Medicina (Kaunas) 59:347.
PubMedアブストラクト|フルテキスト|Google Scholar
井庭康博、原田知行、堀江慎一郎、出浦一成、岩部達夫、寺川直樹(2004)。リポ多糖は腫瘍壊死因子αおよびインターロイキン-8の発現誘導を介して子宮内膜間質細胞の増殖を促進した。Fertil. Steril. この論文では、子宮内膜細胞の増殖が、腫瘍壊死因子αおよびインターロイキン-8の発現誘導を介して促進されることを明らかにした。
PubMed Abstract|フルテキスト|Google Scholar
Insenser, M., Murri, M., Del Campo, R., Martinez-Garcia, M. A., Fernandez-Duran, E., and Escobar-Morreale, H. F. (2018). 腸内細菌叢と多嚢胞性卵巣症候群:性、性ホルモン、肥満の影響。J. Clin. Endocrinol. Metab. 103, 2552-2562. doi: 10.1210/jc.2017-02799
PubMedアブストラクト|フルテキスト|Google Scholar
伊藤博之、指原崇、細野晃、上ノ川聡、内田雅也(2011).Lactobacillus gasseri OLL2809は、マウス子宮内膜症モデルにおいてNK細胞の活性化を介して腹腔内の異所性子宮内膜細胞の発生を抑制する。細胞工学 63, 205-210.
パブコメ要旨|全文|Google Scholar
Ivanov, I., Atarashi, K., Manel, N., Brodie, E. L., Shima, T., Karaoz, U., et al. 分節した糸状菌による腸管Th17細胞の誘導。細胞 139, 485-498.
PubMedアブストラクト|フルテキスト|Google Scholar
郭嘉祥(Guo, J. Y., Rong, Y., et al.) 腸内細菌叢と子宮内膜症との関連:2標本メンデルランダム化研究。Front. Microbiol. 14:1188458. doi: 10.3389/fmicb.2023.1188458.
PubMedアブストラクト|フルテキスト|Google Scholar
Jin, M., Kalainy, S., Baskota, N., Chiang, D., Deehan, E. C., Mcdougall, C., et al. 肝硬変患者の糞便微生物叢は、難消化性炭水化物を短鎖脂肪酸に発酵させる能力が低い。Liver Int. 39, 1437-1447. doi: 10.1111/liv.14106.
パブコメ抄録|全文|Google Scholar
Johnsen, P. H., Hilpusch, F., Cavanagh, J. P., Leikanger, I. S., Kolstad, C., Valle, P. C., et al. 中等度から重度の過敏性腸症候群に対する便微生物叢移植対プラセボ:二重盲検無作為化プラセボ対照並行群間単施設試験。Lancet Gastroenterol. Hepatol. 3, 17-24. doi: 10.1016/S2468-1253(17)30338-2
PubMed Abstract|フルテキスト|Google Scholar
Kaliannan, K., Wang, B., Li, X. Y., Kim, K. J., and Kang, J. X. (2015). 代謝性内毒素血症に対するオメガ6脂肪酸とオメガ3脂肪酸の相反する効果を媒介する宿主-マイクロバイオーム相互作用。Sci.Rep.5:11276。
PubMedアブストラクト|フルテキスト|Google Scholar
Khan, K. N., Fujishita, A., Kitajima, M., Hiraki, K., Nakashima, M., and Masuzaki, H. (2014). 子宮内膜症女性における子宮内微生物のコロニー形成と子宮内膜炎の発生dagger. Hum. Reprod. 29, 2446-2456. doi: 10.1093/humrep/deu222
PubMedアブストラクト|全文|Google Scholar
Khan, K. N., Kitajima, M., Hiraki, K., Yamaguchi, N., Katamine, S., Matsuyama, T., et al. 月経血の大腸菌汚染と子宮内膜症に及ぼす細菌内毒素の影響. Fertil. Steril. 94,2860-2863.e3.doi:10.1016/j.fertnstert.2010.04.053。
PubMedアブストラクト|フルテキスト|Google Scholar
Khan, K. N., Kitajima, M., Inoue, T., Fujishita, A., Nakashima, M., and Masuzaki, H. (2015). 17β-エストラジオールとリポ多糖は相加的に骨盤内炎症と子宮内膜症の増殖を促進する。Reprod. Sci. 22, 585-594. doi: 10.1177/1933719114556487.
Google Scholar
Khan, K. N., Kitajima, M., Yamaguchi, N., Fujishita, A., Nakashima, M., Ishimaru, T., et al. 子宮内膜症女性における細菌増殖におけるプロスタグランジンE2の役割。Hum. Reprod. 27, 3417-3424. doi: 10.1093/humrep/des331
PubMedアブストラクト|全文|Google Scholar
Khodaverdi, S., Mohammadbeigi, R., Khaledi, M., Mesdaghinia, L., Sharifzadeh, F., Nasiripour, S., et al. 子宮内膜症に苦しむ女性の痛みの重症度に対する経口乳酸菌の有益な効果:試験的プラセボ対照無作為化臨床試験。Int. J. Fertil. Steril. 13, 178-183. doi: 10.22074/ijfs.2019.5584
PubMedアブストラクト|フルテキスト|Google Scholar
Kim, S. K., Guevarra, R. B., Kim, Y. T., Kwon, J., Kim, H., Cho, J. H., et al. ヒト腸内細菌関連疾患におけるプロバイオティクスの役割。J. Microbiol. Biotechnol. 29, 1335-1340. doi: 10.4014/jmb.1906.06064.
パブコメ抄録|全文|Google Scholar
Kim, K. H., Lee, E. N., Park, J. K., Lee, J. R., Kim, J. H., Choi, H. J., et al. クルクミンは、ヒト子宮内膜間質細胞におけるTNFα誘導性の細胞間接着分子-1、血管細胞接着分子-1および炎症性サイトカインの発現を抑制する。Phytother. 論文概要: ヒト子宮内膜間質細胞における細胞間接着分子-1、血管細胞接着分子-1、炎症性サイトカイン。
PubMedアブストラクト|フルテキスト|Google Scholar
木村郁夫、市村明宏、大上北野玲子、五十嵐雅彦(2020)。健康と疾患における遊離脂肪酸受容体。Physiol. 100, 171-210. doi: 10.1152/physrev.00041.2018.
PubMedアブストラクト|フルテキスト|Google Scholar
小林秀雄、住本和彦、門岩直樹、今井雅人、高倉健一、黒巻哲夫、他(2007).卵巣子宮内膜腫女性における卵巣がん発症リスク:静岡県におけるコホート研究。Int. J. Gynecol. DOI: 10.1111/j.1525-1438.2006.00754.x.
PubMed Abstract|フルテキスト|Google Scholar
Kootte, R. S., Levin, E., Salojarvi, J., Smits, L. P., Hartstra, A. V., Udayappan, S. D., et al. メタボリックシンドロームにおけるリーンドナー糞便後のインスリン感受性の改善は、ベースラインの腸内細菌叢組成によって駆動される。Cell Metab. 26:e616, 611-619.e6. doi: 10.1016/j.cmet.2017.09.008
PubMed Abstract|フルテキスト|Google Scholar
Laborda-Illanes, A., Sanchez-Alcoholado, L., Dominguez-Recio, M. E., Jimenez-Rodriguez, B., Lavado, R., Comino-Mendez, I., et al. 乳がんの病態と治療における乳腺と腸内細菌叢の作用機序。doi: 10.3390/cancers12092465.
PubMedアブストラクト|クロス全文|Google Scholar
Le, N., Cregger, M., Fazleabas, A., and Braundmeier-Fleming, A. (2022). 子宮内膜症がオリーブヒヒの雌における免疫と粘膜微生物群集動態に及ぼす影響。子宮内膜症がヒヒの雌の免疫と粘膜微生物群集動態に及ぼす影響。
パブコメ抄録|全文|Google Scholar
Leavy, O. (2015). 生殖免疫学: 子宮内膜症における免疫サーベイランスの回避。Nat. Rev. Immunol. 15:729. doi: 10.1038/nri3942
PubMedアブストラクト|フルテキスト|Google Scholar
Li,Y.、Xu,S.、Wang,L.、Shi,H.、Wang,H.、Fang,Z.、他(2023)。腸内微生物の遺伝子変異は宿主の寿命、睡眠、運動能力を調節する。ISME J. 17, 1733-1740. doi: 10.1038/s41396-023-01478-x
PubMedアブストラクト|フルテキスト|Google Scholar
Liang, Z., Di, N., Li, L., and Yang, D. (2021). 腸内細菌叢の変化から、多嚢胞性卵巣症候群における腸脳軸の変化の可能性が明らかになった。J. Endocrinol. Investig. 44, 1727-1737. doi: 10.1007/s40618-020-01481-5
パブコメ抄録|全文|Google Scholar
Liang, Y., Xie, H., Wu, J., Liu, D., and Yao, S. (2018). 子宮内膜症におけるマクロファージ-神経相互作用におけるエストロゲンの悪役。Reprod. Biol. Endocrinol. 16:122. doi: 10.1186/s12958-018-0441-z
パブコメ要旨|全文|Google Scholar
Liu, J., Liu, X., Duan, K., Zhang, Y., and Guo, S. W. (2012). 卵巣子宮内膜腫におけるtransient receptor potential vanilloid 1の発現と機能性。Reprod. この論文では、卵巣子宮内膜腫における一過性受容体ポテンシャルバニロイド1の発現と機能性について検討した。
パブコメ抄録|全文|Google Scholar
Liu, Z. Z., Liu, Q. H., Liu, Z., Tang, J. W., Chua, E. G., Li, F., et al. 桑の葉のエタノール抽出物は、部分的に腸内細菌叢の組成を回復し、2型糖尿病ラットの肝臓グリコーゲン脆弱性を強化する。BMC Complement. Med. Ther. 21:172. doi: 10.1186/s12906-021-03342-x
PubMedアブストラクト|全文|Google Scholar
Maddern,J.、Grundy,L.、Castro,J.、Brierley,S. M. (2020). 子宮内膜症における疼痛。Front. Cell. Neurosci. 14:590823. doi: 10.3389/fncel.2020.590823
PubMedアブストラクト|フルテキスト|Google Scholar
Maroun, P., Cooper, M. J., Reid, G. D., and Keirse, M. J. (2009). 子宮内膜症における消化器症状の関連性。Aust. N. Z. J. Obstet. Gynaecol. 49, 411-414. doi: 10.1111/j.1479-828X.2009.01030.x
PubMedアブストラクト|フルテキスト|Google Scholar
Mayer, E. A., Nance, K., and Chen, S. (2022). 腸脳軸。Annu. Rev. Med. 73, 439-453. doi: 10.1146/annurev-med-042320-014032.
全文|Google Scholar
Mazmanian, S. K., Liu, C. H., Tzianabos, A. O., and Kasper, D. L. (2005). 共生細菌の免疫調節分子は、宿主免疫系の成熟を誘導する。このような研究は、免疫系の成熟を制御する上で重要である。
PubMedアブストラクト|フルテキスト|Google Scholar
Meng, J., Banerjee, S., Zhang, L., Sindberg, G., Moidunny, S., Li, B., et al. オピオイドはHIV感染ヒト化マウスの腸管上皮修復を障害する。Front. Immunol. 10:2999. doi: 10.3389/fimmu.2019.02999
PubMedアブストラクト|フルテキスト|Google Scholar
遺伝子アテンションを用いた非対称オートエンコーダを用いた単一細胞データ解析フレームワーク。Comput. Biol. Med. 165:107414. doi: 10.1016/j.compbiomed.2023.107414
論文要旨|全文|Google Scholar
Milajerdi, A., Sadeghi, O., Siadat, S. D., Keshavarz, S. A., Sima, A., Vahedi, H., et al. 潰瘍性大腸炎患者における発酵性オリゴ糖、二糖類、単糖類、ポリオールの少ない食事が腸内細菌叢と炎症に及ぼす影響を検討するランダム化比較試験:ランダム化比較試験の試験計画書。論文タイトル:「腸内細菌叢と炎症に及ぼす単糖類・多糖類・ポリオールの影響:無作為化比較試験のプロトコール」。
PubMedアブストラクト|全文|Google Scholar
Missmer, S. A., Chavarro, J. E., Malspeis, S., Bertone-Johnson, E. R., Hornstein, M. D., Spiegelman, D., et al. 食事脂肪摂取と子宮内膜症リスクに関する前向き研究。Hum. Reprod. 25, 1528-1535.
PubMed Abstract|全文|Google Scholar
Moore, J. S., Gibson, P. R., Perry, R. E., and Burgell, R. E. (2017). 過敏性腸症候群患者における子宮内膜症: 特異的な症状と人口統計学的プロフィール、および低FODMAP食への反応。Aust. N. Z. J. Obstet. Gynaecol. 57, 201-205.
PubMed Abstract|フルテキスト|Google Scholar
森 崇、伊藤 文、小柴 敦、片岡 裕、高岡 修、沖村 浩之、他(2019).子宮内膜症における局所エストロゲン形成とその制御。Reprod. Med. 18, 305-311. doi: 10.1002/rmb2.12285.
PubMedアブストラクト|全文|Google Scholar
村上和彦、小谷祐子、城亮一郎、高谷秀樹、中井裕之、松村直樹(2020).子宮内膜症関連卵巣癌は子宮内膜嚢胞の経過観察中に早期に発生する。Int. J. Clin. Oncol. 25, 51-58. doi: 10.1007/s10147-019-01536-5
PubMedアブストラクト|フルテキスト|Google Scholar
Ni,Z.、Ding,J.、Zhao,Q.、Cheng,W.、Yu,J.、Zhou,L.、他(2021)。α-リノレン酸は、子宮内膜症モデルマウスにおける腸内細菌叢と炎症環境を制御する。Am. J. Reprod. Immunol. 86:e13471。
PubMedアブストラクト|全文|Google Scholar
Ni,Z.、Sun,S.、Bi,Y.、Ding,J.、Cheng,W.、Yu,J.、他(2020)。子宮内膜症マウスにおける糞便メタボロームと腸内細菌叢の相関。Am. J. Reprod. Immunol. 84:e13307. doi: 10.1111/aji.13307.
PubMedアブストラクト|全文|Google Scholar
Olovsson, M. (2011). 子宮内膜症の免疫学的側面:最新情報。Am. J. Reprod. Immunol. 66, 101-104. doi: 10.1111/j.1600-0897.2011.01045.x
Google Scholar
Park, G. B., Chung, Y. H., and Kim, D. (2017). TLR依存性PI3K活性化によるガレクチン-1の誘導は、転移性卵巣がん細胞の上皮間葉転換を促進する。Oncol. Rep. 37, 3137-3145. doi: 10.3892/or.2017.5533.
全文|Google Scholar
Petrelluzzi, K. F., Garcia, M. C., Petta, C. A., Grassi-Kassisse, D. M., and Spadari-Bratfisch, R. C. (2008). 子宮内膜症と慢性骨盤痛の女性における唾液中コルチゾール濃度、ストレス、QOL。ストレス 11, 390-397.
PubMedアブストラクト|フルテキスト|Google Scholar
Plottel, C. S., and Blaser, M. J. (2011). マイクロバイオームと悪性腫瘍。細胞宿主微生物 10, 324-335.
PubMedアブストラクト|フルテキスト|Google Scholar
Quinones, M., Urrutia, R., Torres-Reveron, A., Vincent, K., and Flores, I. (2015). 子宮内膜症患者における不安、対処スキル、視床下部-下垂体-副腎(HPA)軸。J. Reprod. doi: 10.7243/2054-0841-3-2.
パブコメ抄録|全文|Google Scholar
Quraishi, M. N., Widlak, M., Bhala, N., Moore, D., Price, M., Sharma, N., et al. メタ解析を伴う系統的レビュー:再発性および難治性クロストリジウム・ディフィシル感染症の治療に対する糞便微生物叢移植の有効性。Aliment. Pharmacol. Ther. 46, 479-493.
PubMed Abstract | Crossref Full Text | Google Scholar
Raia, V., Maiuri, L., Ciacci, C., Ricciardelli, I., Vacca, L., Auricchio, S., et al. p38マイトジェン活性化プロテインキナーゼの阻害は、嚢胞性線維症における気道炎症を制御する。(2005)嚢胞性線維症におけるp38マイトジェン活性化プロテインキナーゼの阻害による気道炎症の制御.
パブコメ抄録|全文|Google Scholar
Ramakrishna, B. S. (2013). ヒトの栄養と代謝における腸内細菌叢の役割。J. Gastroenterol. Hepatol. 28, 9-17. doi: 10.1111/jgh.12294
Google Scholar
Ratajczak, W., Ryl, A., Mizerski, A., Walczakiewicz, K., Sipak, O., and Laszczynska, M. (2019). 腸内細菌由来の短鎖脂肪酸(SCFA)の免疫調節能。Acta Biochim. Pol. 66, 1-12. doi: 10.18388/abp.2018_2648.
PubMedアブストラクト|フルテキスト|Google Scholar
Rooks, M. G., and Garrett, W. S. (2016). 腸内細菌叢、代謝産物、宿主免疫。Nat. Rev. Immunol. 16, 341-352. doi: 10.1038/nri.2016.42
PubMedアブストラクト|フルテキスト|Google Scholar
Rutkowski, M. R., Svoronos, N., Perales-Puchalt, A., and Conejo-Garcia, J. R. (2015). 腫瘍マクロ環境:腫瘍床を超えたがん促進ネットワーク。Adv. DOI: 10.1016/bs.acr.2015.04.011.
PubMedアブストラクト|フルテキスト|Google Scholar
Saad, M. J., Santos, A., and Prada, P. O. (2016). 腸内細菌叢と炎症と肥満およびインスリン抵抗性の関連性。生理学(ベセスダ)31, 283-293.
全文|Google Scholar
Salliss, M. E., Farland, L. V., Mahnert, N. D., and Herbst-Kralovetz, M. M. (2021). 子宮内膜症、不妊症、慢性骨盤痛における腸内細菌叢と性器細菌叢、エストロボロームの役割。Hum. Reprod. Doi: 10.1093/humupd/dmab035
PubMedアブストラクト|全文|Google Scholar
Samartzis,E.P.、Noske,A.、Samartzis,N.、Fink,D.、Imesch,P. (2013). 子宮内膜症では、ヒストン脱アセチル化酵素1の発現が有意に増加するが、他のクラスIヒストン脱アセチル化酵素の発現は増加しない。Reprod. 子宮内膜症ではヒストン脱アセチル化酵素1の発現が有意に上昇するが、他のクラスIヒストン脱アセチル化酵素の発現は上昇しない。
パブコメ抄録|全文|Google Scholar
Saunders, P. T. K., and Horne, A. W. (2021). 子宮内膜症: 子宮内膜症:病因、病理生物学、および治療の展望。細胞 184, 2807-2824.
パブコメ抄録|全文|Google Scholar
Schirbel, A., Kessler, S., Rieder, F., West, G., Rebert, N., Asosingh, K., et al. TLRとNLRの血管新生促進活性:腸内細菌叢と腸管血管新生との新たな関連性。胃腸病学144:e619, 613-623.e9. doi: 10.1053/j.gastro.2012.11.005
PubMedアブストラクト|フルテキスト|Google Scholar
Seaman, H. E., Ballard, K. D., Wright, J. T., and De Vries, C. S. (2008). 子宮内膜症と過敏性腸症候群および骨盤内炎症性疾患との併存:全国症例対照研究からの所見--第2部。BJOG 115, 1392-1396. doi: 10.1111/j.1471-0528.2008.01879.x
全文|Google Scholar
Ser, H. L., Au Yong, S. J., Shafiee, M. N., Mokhtar, N. M., and Ali, R. A. R. (2023). 子宮内膜症におけるマイクロバイオームの役割に関する最新情報:ナラティブレビュー。微生物11:360.
PubMedアブストラクト|フルテキスト|Google Scholar
Shan, Y., Lee, M., and Chang, E. B. (2022). 腸内細菌叢と炎症性腸疾患。Annu. Rev. Med. 73, 455-468. doi: 10.1146/annurev-med-042320-021020
パブコメ抄録|全文|Google Scholar
Shan,J.,Ni,Z.,Cheng,W.,Zhou,L.,Zhai,D.,Sun,S.,他(2021年)。ステージ3/4の子宮内膜症患者における腸内細菌叢の不均衡とホルモンおよび炎症因子との相関。Arch. Gynecol. Obstet. 304, 1363-1373. doi: 10.1007/s00404-021-06057-z
PubMedアブストラクト|フルテキスト|Google Scholar
燕麦のβ-グルタミン酸の効果。オート麦βグルカンおよび大麦βグルカンがラットの糞便性状、腸内細菌叢および腸内細菌代謝産物に及ぼす影響。J. Agric. Food Chem. 60, 11301-11308.
パブコメ抄録|全文|Google Scholar
Shigesi, N., Kvaskoff, M., Kirtley, S., Feng, Q., Fang, H., Knight, J. C., et al. 子宮内膜症と自己免疫疾患との関連:系統的レビューとメタアナリシス。Hum. Reprod. Update 25, 486-503. doi: 10.1093/humupd/dmz014.
PubMedアブストラクト|全文|Google Scholar
Silva, Y. P., Bernardi, A., and Frozza, R. L. (2020). 腸-脳コミュニケーションにおける腸内細菌叢由来の短鎖脂肪酸の役割。Front. Endocrinol. (ローザンヌ)11:25. doi: 10.3389/fendo.2020.00025
PubMedアブストラクト|フルテキスト|Google Scholar
Simpson, C. A., Diaz-Arteche, C., Eliby, D., Schwartz, O. S., Simmons, J. G., and Cowan, C. S. M. (2021). 不安とうつ病における腸内細菌叢-系統的レビュー。Clin. Psychol. doi: 10.1016/j.cpr.2020.101943.
全文|Google Scholar
Strandwitz, P. (2018). 腸内細菌叢による神経伝達物質調節。脳 Res. 1693, 128-133. doi: 10.1016/j.brainres.2018.03.015
PubMedアブストラクト|フルテキスト|Google Scholar
Strowig, T., Henao-Mejia, J., Elinav, E., and Flavell, R. (2012). 健康と疾患におけるインフラマソーム。Nature 481, 278-286.
Google Scholar
Su, H., Li, Y. T., Heitkemper, M. M., and Zia, J. (2019). 過敏性腸症候群の症状と腸内細菌叢に対する低FODMAPS食の効果。Gastroenterol. Nurs. 42, 150-158. doi: 10.1097/SGA.000000000428
PubMedアブストラクト|フルテキスト|Google Scholar
Svensson, A., Brunkwall, L., Roth, B., Orho-Melander, M., and Ohlsson, B. (2021). 子宮内膜症と腸内細菌叢との関連。Reprod. Sci.28,2367-2377.doi:10.1007/s43032-021-00506-5。
PubMedアブストラクト|フルテキスト|Google Scholar
Tarokh, M., Ghaffari Novin, M., Poordast, T., Tavana, Z., Nazarian, H., Norouzian, M., et al. 子宮内膜症の不妊女性における血清および腹膜液サイトカインプロファイル。Iran. J. Immunol. 16, 151-162. doi: 10.22034/IJI.2019.80258.
PubMedアブストラクト|フルテキスト|Google Scholar
Taylor, H. S., Kotlyar, A. M., and Flores, V. A. (2021). 子宮内膜症は慢性全身性疾患である:臨床的課題と新たなイノベーション。Lancet 397, 839-852. doi: 10.1016/s0140-6736(21)00389-5
PubMedアブストラクト|フルテキスト|Google Scholar
徳重直樹、Markham, R.、Russell, P.、Fraser, I. S. (2006). 子宮内膜症女性における子宮内膜機能層の小神経線維の高密度。Hum. Reprod. 21, 782-787. doi: 10.1093/humrep/dei368
PubMedアブストラクト|全文|Google Scholar
オメガ-3多価不飽和脂肪酸(Omega-3 polyunaturis)の血中濃度は、オメガ-3多価不飽和脂肪酸(Omega-3 polyunaturis)の血中濃度を上回ると考えられている。オメガ3多価不飽和脂肪酸は、トランスジェニックマウスモデルにおいて腹膜子宮内膜症の嚢胞性病変形成を抑制する。PLoS One 8:e73085. doi: 10.1371/journal.pone.0073085.
PubMedアブストラクト|フルテキスト|Google Scholar
Uccello, M., Malaguarnera, G., Basile, F., D'agata, V., Malaguarnera, M., Bertino, G., et al. 大腸がん予防におけるプロバイオティクスの潜在的役割。BMC Surg. 12:S35. doi: 10.1186/1471-2482-12-S1-S35.
PubMedアブストラクト|フルテキスト|Google Scholar
Vercellini, P., Barbara, G., Abbiati, A., Somigliana, E., Vigano, P., and Fedele, L. (2009). 再発性症候性子宮内膜症に対する反復手術:どうすべきか?Eur. J. Obstet. Gynecol. Reprod. doi: 10.1016/j.ejogrb.2009.05.007
Google Scholar
Wang,J.,Li,Z.,Ma,X.,Du,L.,Jia,Z.,Cui,X.,他(2021)。膣内細菌叢のトランスロケーションは、子宮の健康障害と保護に関与する。Nat. Commun. 12:4191. doi: 10.1038/s41467-021-24516-8
PubMedアブストラクト|フルテキスト|Google Scholar
Wang, T., Sun, J., and Zhao, Q. (2023). 分子フィンガープリントとグラフアテンションメカニズムを用いたhERGチャネルブロッカーに関連する心毒性の調査。Comput. Biol. Med. 153:106464. doi: 10.1016/j.compbiomed.2022.106464.
PubMedアブストラクト|フルテキスト|Google Scholar
Wang, Y., Yin, Y., Chen, X., Zhao, Y., Wu, Y., Li, Y., et al. Induction of intestinal Th17 cells by flagellins from segmented filamentous bacteria. Front. Immunol. 10:2750. doi: 10.3389/fimmu.2019.02750.
PubMedアブストラクト|フルテキスト|Google Scholar
Wang, Q., Zhao, L., Han, L., Fu, G., Tuo, X., Ma, S., et al. 卵巣がん組織と非がん組織のin situにおける細菌の分布の違い。J. Ovarian Res. 13:8. doi: 10.1186/s13048-019-0603-4.
PubMedアブストラクト|フルテキスト|Google Scholar
Wang, L., Zhu, Z. B., Zhang, L., Li, J., and Zhao, Q. (2023). 論説: データ駆動型アプローチにより、ヒトの微生物叢と複雑な疾患との間の広範なつながりと緊密な相互作用を解明する。Front. Microbiol. 14:1157579.
PubMedアブストラクト|フルテキスト|Google Scholar
Wei,Y.、Tan,H.、Yang,R.、Yang,F.、Liu,D.、Huang,B.、他(2023)。腸内細菌異常症由来のβ-グルクロニダーゼは子宮内膜症の発症を促進する。Fertil. Steril. 120, 682-694. doi: 10.1016/j.fertnstert.2023.03.032
PubMedアブストラクト|フルテキスト|Google Scholar
Wu, J., Xie, H., Yao, S., and Liang, Y. (2017). 子宮内膜症におけるマクロファージと神経の相互作用。doi: 10.1186/s12974-017-0828-3.
PubMedアブストラクト|フルテキスト|Google Scholar
Xu, J., Li, K., Zhang, L., Liu, Q.-Y., Huang, Y.-K., Kang, Y., et al. 腸内細菌叢のディスバイオーシスは、炎症経路の活性化を介して子宮内膜症患者の慢性ストレスに寄与する。Reprod. Dev. Med. 1, 221-227. doi: 10.4103/2096-2924.224916.
Google Scholar
矢内田直樹、吉原和彦、山口正樹、須田健一、田村理恵、榎本知行(2021).子宮内膜症はどのようにして卵巣がんに至るのか?子宮内膜症関連卵巣がん発生の分子機構。doi: 10.3390/cancers13061439.
PubMedアブストラクト|フルテキスト|Google Scholar
Yang,H.、Liu,Y.、Cai,R.、Li,Y.、およびGu,B. (2021). 腸内細菌叢と精神神経疾患との関係に関する叙述的レビュー:プロバイオティクスとプレバイオティクスのメカニズムと臨床応用。Ann. Palliat. Med. 10, 2304-2313.
Google Scholar
Yang, J., Tan, Q., Fu, Q., Zhou, Y., Hu, Y., Tang, S., et al. Gastrointestinal microbiome and breast cancer: correlations, mechanism and potential clinical implications. doi: 10.1007/s12282-016-0734-z
PubMedアブストラクト|フルテキスト|Google Scholar
Yang,G.、Wei,J.、Liu,P.、Zhang,Q.、Tian,Y.、Hou,G.、他(2021年)。2型糖尿病および関連疾患における腸内細菌叢の役割。メタボリズム 117:154712.
全文|Google Scholar
Yuan, M., Li, D., Zhang, Z., Sun, H., An, M., and Wang, G. (2018). 子宮内膜症はマウスにおいて腸内細菌叢の変化を誘導する。Hum. Reprod. 33, 607-616. doi: 10.1093/humrep/dex372
PubMedアブストラクト|全文|Google Scholar
Yuan, X., Wang, L., Bhat, O. M., Lohner, H., and Li, P. L. (2018). 内皮Nlrp3インフラマソーム活性化と新生内膜形成に対する短鎖脂肪酸の作用の違い: 酪酸の抗酸化作用。レドックスバイオロジー(Redox Biol)16, 21-31.
PubMedアブストラクト|フルテキスト|Google Scholar
Zhang, J., Sun, Z., Jiang, S., Bai, X., Ma, C., Peng, Q., et al. プロバイオティクスBifidobacterium lactis V9は、腸脳軸を介して多嚢胞性卵巣症候群患者の性ホルモンの分泌を制御する。
PubMedアブストラクト|フルテキスト|Google Scholar
Zhang, Z., Tang, H., Chen, P., Xie, H., and Tao, Y. (2019). 腸内マイクロバイオームによる宿主免疫、代謝、腸管外腫瘍の操作の解明。Signal Transduct. Target. Ther. 4:41. doi: 10.1038/s41392-019-0074-5
PubMedアブストラクト|フルテキスト|Google Scholar
Zhang, C. X., Wang, H. Y., and Chen, T. X. (2019). 腸内細菌叢/プロバイオティクスと免疫系との相互作用。Biomed. Res. Int. 2019, 6764919-6764918.
PubMedアブストラクト|フルテキスト|Google Scholar
Zhang, F., Xiong, Y., Wu, K., Wang, L., Ji, Y., and Zhang, B. (2023). 腸内細菌叢と不妊症リスクに関する遺伝学的洞察:メンデルランダム化研究。微生物11:2319.
PubMedアブストラクト|フルテキスト|Google Scholar
Zhou, S. Y., Gillilland, M. 3rd, Wu, X., Leelasinjaroen, P., Zhang, G., Zhou, H., et al. FODMAP食は、リポ多糖が介在する腸炎症とバリア機能障害によって内臓侵害受容を調節する。J. Clin. Invest. 128, 267-280. doi: 10.1172/JCI92390
PubMedアブストラクト|フルテキスト|Google Scholar
Zhou, B., Sun, C., Huang, J., Xia, M., Guo, E., Li, N., et al. 卵巣がん患者におけるマイクロバイオームの生物多様性組成。Sci.Rep.9:1691。
PubMedアブストラクト|フルテキスト|Google Scholar
Zhu, Y., Li, Y., Zhang, Q., Song, Y., Wang, L., and Zhu, Z. (2022). 腸内細菌叢と神経ミトコンドリアの相互作用:腸から脳への伝達経路に関する新たな視点。Front. Microbiol. 13:798917.
PubMedアブストラクト|フルテキスト|Google Scholar
キーワード:腸内細菌叢、子宮内膜症、エストロゲン、炎症、免疫
引用 子宮内膜症の病因における腸内細菌叢の役割:総説。Front. Microbiol. 15:1363455.
受理された: 30 December 2023; Accepted: 2024年2月19日;
発行:2024年3月5日
編集者
中国広東省人民病院Liang Wang氏
査読者
Chunchun Wang, 江南大学, 中国
Jie Lyu, 中国科学院大学, 中国
Copyright © 2024 Guo and Zhang. これはクリエイティブ・コモンズ表示ライセンス(CC BY)の条件の下で配布されるオープンアクセス論文である。原著者および著作権者のクレジットを明記し、学術的に認められている慣例に従って本誌の原著を引用することを条件に、他のフォーラムでの使用、配布、複製を許可する。これらの条件に従わない使用、配布、複製は許可されない。
*文責 Chiyuan Zhang, zhangcy@sj-hospital.org
免責事項:本論文で表明されたすべての主張は、あくまで著者個人のものであり、必ずしも所属団体や出版社、編集者、査読者の主張を代表するものではない。本記事で評価される可能性のあるいかなる製品、またはその製造元が主張する可能性のある主張も、出版社によって保証または支持されるものではない。
フッター
ガイドライン
探る
アウトリーチ
コネクト
フォローする
© 2024 Frontiers Media S.A. 無断複写・転載を禁じます。
プライバシーポリシー
|
ご利用条件
この記事が気に入ったらサポートをしてみませんか?
